
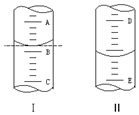
 ①如图Ⅰ表示10mL量筒中液面的位置.A与B,B与C刻度间相差1mL,如果刻度A为6,量筒中液体的体积是5.2 mL.
①如图Ⅰ表示10mL量筒中液面的位置.A与B,B与C刻度间相差1mL,如果刻度A为6,量筒中液体的体积是5.2 mL. 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 碳及其化合物在科技、社会生产、生活中有着广泛的应用.请按要求回答下列问题:
碳及其化合物在科技、社会生产、生活中有着广泛的应用.请按要求回答下列问题:| 温度/℃ | 600 | 750 | 900 | 1100 | 1250 |
| 平衡常数K | 2.5 | 1.6 | 1 | 0.9 | 0.6 |
| A | B | C | D | E | |
| n(CO2) | 3 | 1 | 0 | 1 | 1 |
| n(H2) | 2 | 1 | 0 | 1 | 2 |
| n(CO) | 1 | 2 | 3 | 0.5 | 3 |
| n(H2O) | 5 | 2 | 3 | 0.5 | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe比Cu的金属性强,因此可用FeCl3腐蚀Cu刻制应刷电路板 | |
| B. | 纯碱、小苏打、盐酸分别属于碱、盐、混合物 | |
| C. | 胶体化学是制造纳米材料的有效方法之一 | |
| D. | 用萃取方法分离碘的苯溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 制取水泥和玻璃的原料中均有纯碱 | |
| B. | 普通玻璃是电的绝缘体,这种透明的固体物质是混合物,无固定的熔点 | |
| C. | 普通玻璃俗称水玻璃 | |
| D. | 硅酸盐工业使用的每一种原料都含有硅 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O与Na2O2都是碱性氧化物 | |
| B. | 生石灰能与水反应,可用来干燥氨气 | |
| C. | 从海水中提取物质都必须通过化学反应才能实现 | |
| D. | 氯化铝是一种离子型电解质,可用于电解法制铝 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com