
| A. | 在氯乙烷中直接加入AgNO3溶液 | |
| B. | 加蒸馏水,充分搅拌后,加入AgNO3溶液 | |
| C. | 加入NaOH溶液,加热,然后加入AgNO3溶液 | |
| D. | 加入热的NaOH醇溶液,充分反应后,加入稀硝酸酸化,再加入AgNO3溶液 |
分析 检验氯乙烷中氯元素先使氯乙烷中的氯原子变为氯离子,氯乙烷可以在氢氧化钠水溶液中水解生成氯离子,也可以在氢氧化钠醇溶液中发生消去反应生成氯离子,最后加入硝酸酸化,加入硝酸银,观察是否有白色沉淀生成,以此解答.
解答 解:A.在氯乙烷中直接加入AgNO3溶液,不发生反应,不能鉴别,故A错误;
B.在氯乙烷中加蒸馏水,然后加入AgNO3溶液,不发生反应,不能鉴别,故B错误;
C.加入NaOH溶液,加热,发生水解,然后加入AgNO3溶液,因没有酸化,不能排出AgOH的干扰,故C错误;
D.在氯乙烷中加入NaOH溶液,加热,发生水解生成NaCl,冷却后酸化,然后加入AgNO3溶液,生成白色沉淀可鉴别,故D正确;
故选D.
点评 本题考查氯代烃中的元素的检验,为基础性习题,把握卤代烃的水解、消去反应为解答的关键,注意必须先加稀硝酸酸化,再根据是否产生白色沉淀来确定是否存在氯元素,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | Na、C、P、S分别在足量氧气中燃烧均生成一种相应氧化物:Na2O2、CO2、P2O5、SO3 | |
| B. | 稀硝酸、稀硫酸均能将木炭氧化成二氧化碳,浓硝酸、浓疏酸都能使铁、铝钝化 | |
| C. | 欲鉴别NO2、Br2(g)两种红棕色气体,将两种待测气体分別通入AgNO3溶液中 | |
| D. | 将久置于空气中的Fe(NO3)2样品溶于稀H2SO4后,滴加KSCN溶液,溶液变为红色,说 明Fe(NO3)2样品在空气中已变质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
时间 浓度 | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.00 | 0.68 | 0.50 | 0.50 | 0.60 | 0.60 |
| N2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
| CO2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |

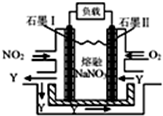
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
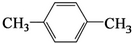
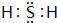 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
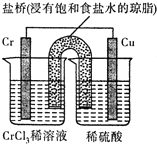 铬(Cr)是周期表中VIB族元素,化合价可以是 0~+6 的整数价态.回答下列问题:
铬(Cr)是周期表中VIB族元素,化合价可以是 0~+6 的整数价态.回答下列问题: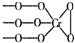 ,则Cr的化合价为+5.
,则Cr的化合价为+5.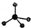 .CrO72-由两个CrO42-四面体组成,这两个CrO42-四面体通过共用一个角顶氧原子彼连,结构为
.CrO72-由两个CrO42-四面体组成,这两个CrO42-四面体通过共用一个角顶氧原子彼连,结构为 .则由n(n>1)个CrO42-通过角顶氧原子连续的链式结构的化学式为CrnO(3n+1)2-.
.则由n(n>1)个CrO42-通过角顶氧原子连续的链式结构的化学式为CrnO(3n+1)2-.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 混合物 | 试剂 | 分离方法 | |
| A | Fe(碘) | - | 加热 |
| B | 二氧化碳(氯化氢) | 饱和Na2CO3溶液 | 洗气 |
| C | 乙酸乙酯(乙酸) | NaOH溶液 | 蒸馏 |
| D | 淀粉(氯化钠) | 蒸馏水 | 渗析 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 酸 | 醋酸 | 次氯酸 | 亚硝酸 |
| 电离常数 | 1.7×10-5 | 3.0×10-8 | 7.1×10-4 |
| A. | pH相同的氯水和亚硝酸溶液中水电离的c(H+)相同 | |
| B. | 向氯水中滴加氢氧化钠溶液至中性:c(Na+)=2 c(ClO-)+c(HClO) | |
| C. | 向漂白粉溶液中滴加H2SO3溶液可增强其漂白能力 | |
| D. | pH相同的醋酸钠、次氯酸钠和亚硝酸钠溶液中,c(Na+)最大的是亚硝酸钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
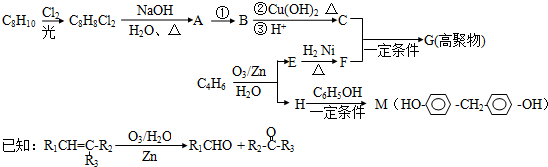
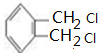
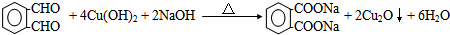
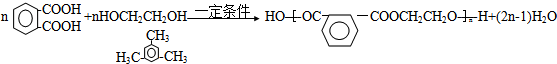
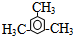 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com