
【题目】图1为甲烷和O2构成的燃料电池示意图,电解质为KOH溶液,图2为电解AlCl3溶液的装置,电极材料均为石墨。用该装置进行实验,反应开始后观察到x电极附近出现白色沉淀。下列说法正确的是

A.图1中电解质溶液的pH增大
B.图2中电解AlCl3溶液的总反应为2Cl-+2H2O![]() Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
C.A处通入的气体为CH4,电极反应式为CH4+10OH--8e-= CO32-+7H2O
D.电解池中Cl-向x极移动
【答案】C
【解析】
试题分析:A.原电池中,负极:CH4+10OH--8e-=CO3 2-+7H2O,正极:2O2+4H2O+8e-=8OH-,总方程式:CH4+2O2+2OH-=CO32-+3H2O,溶液由碱变成盐溶液,所以溶液的PH值变小,故A错误;B.电解池中电池反应式为2AlCl3+6H2O![]() 3Cl2↑+3H2↑+2Al(OH)3↓,故B错误;C.反应开始后观察到x电极附近出现白色沉淀,说明X电极上氢离子放电,X电极附近生成氢氧根离子,所以X电极是阴极,Y电极是阳极,则a负极,b是正极,负极上是燃料失电子发生氧化反应,电极反应式为CH4+10OH--8e-═CO32-+7H2O,故C正确;D.反应开始后观察到x电极附近出现白色沉淀,说明X电极上氢离子放电,X电极附近生成氢氧根离子,所以X电极是阴极,Y电极是阳极,电解池中Cl-向y极移动,故D错误;故选C。
3Cl2↑+3H2↑+2Al(OH)3↓,故B错误;C.反应开始后观察到x电极附近出现白色沉淀,说明X电极上氢离子放电,X电极附近生成氢氧根离子,所以X电极是阴极,Y电极是阳极,则a负极,b是正极,负极上是燃料失电子发生氧化反应,电极反应式为CH4+10OH--8e-═CO32-+7H2O,故C正确;D.反应开始后观察到x电极附近出现白色沉淀,说明X电极上氢离子放电,X电极附近生成氢氧根离子,所以X电极是阴极,Y电极是阳极,电解池中Cl-向y极移动,故D错误;故选C。


 课堂练加测系列答案
课堂练加测系列答案 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案科目:高中化学 来源: 题型:
【题目】在一定温度下,向一个容积不变的容器中,通入2mol SO2和2mol O2及固体催化剂,使之反应。2SO2(g)+O2(g)![]() 2SO3(g);ΔH=-196 KJ/mol。平衡时容器内气体压强为起始时的90%。此时
2SO3(g);ΔH=-196 KJ/mol。平衡时容器内气体压强为起始时的90%。此时
(1)加入2mol SO2和2mol O2发生反应,达到平衡时,放出的热量为 ;
(2)保持同一反应温度,在相同的容器中,将起始物质的量改为amol SO2、bmol O2、cmol SO3(g),欲使平衡时SO3的体积分数为2/9,
①达到平衡时,⑴与⑵放出的热量 (填序号)。
A.一定相等 B.前者一定小 C.前者大于或等于后者
②a、b、c必须满足的关系是 、 (一个用a、c表示,另一个用b、c表示),
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是某同学用500 mL容量瓶配制0.10 mol·L-1Na2CO3溶液的步骤:
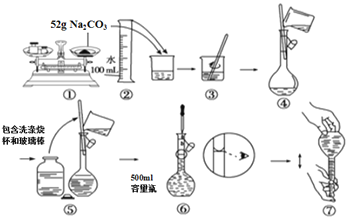
该同学的错误是
A. ①⑤⑥ B. ②④⑦ C. ①⑥ D. ⑤⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:C(s)+O2(g)=CO2(g) △H1=-395kJ/mol,
CO(g)+1/2O2(g)=CO2(g) △H2=-283kJ/mol,
则反应C(s)+1/2O2(g)=CO(g)的反应热△H3等于 ( )
A. -112 kJ/mol B. -395 kJ/mol C. + 112 kJ/mol D. -283 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】空气中CO2的含量及有效利用,已经引起各国的普遍重视
Ⅰ:目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在体积为1L的恒容密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g)△H=﹣49.0kJ/mol;测得CO2和CH3OH(g)的浓度随时间变化如图甲所示.
CH3OH(g)+H2O(g)△H=﹣49.0kJ/mol;测得CO2和CH3OH(g)的浓度随时间变化如图甲所示.
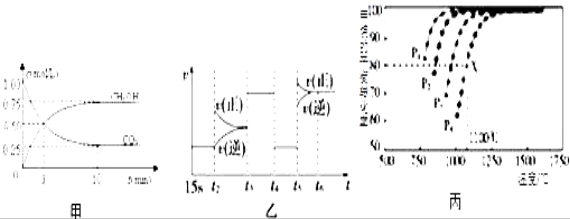
(1)前3min内,平均反应速率v(H2)=_________ _____.此温度下该反应的平衡常数为____________(保留两位小数).
(2)下列措施中,既能使反应加快,又能使![]() 增大的是___________.
增大的是___________.
A.升高温度 B.充入惰性气体 C.将H2O(g)从体系中分离 D.再充入1mol H2
(3)图乙中t5时引起平衡移动的条件是_____________.(填序号)
A.升高温度 B.增大反应物浓度 C.使用催化剂 D.增大体系压强
(4)反应达到平衡后,若向反应体系再加入CO2(g)、H2(g)、CH3OH(g)、H2O(g)各1mol,化学平衡____________(填“正向”、“逆向”或“不”)移动.
Ⅱ:利用CO2(g)+CH4(g) ![]() 2CO(g)+2H2(g)将CO2转化成燃料气.T℃时,在恒容密闭容器中通入物质的量均为0.1mol的CH4与CO2,发生上述反应,测得CH4的平衡转化率与温度及压强的关系如图所示,
2CO(g)+2H2(g)将CO2转化成燃料气.T℃时,在恒容密闭容器中通入物质的量均为0.1mol的CH4与CO2,发生上述反应,测得CH4的平衡转化率与温度及压强的关系如图所示,
(5)下列事实能说明该反应达到平衡的是_______________
a.CO的物质的量不再发生变化
b.混合气体的密度不再发生变化
c.v正(CO2)=2v逆(H2)
d.混合气体压强不再发生变化
e.单位时间内生成n mol CH4的同时消耗2n mol H2
(6)据图可知P1、P2、P3、P4由小到大的顺序是__________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道氢氧燃料电池公交汽车已经驶上北京街头,下列说法中正确的是( )
A.氢氧燃料电池把氢气和氧气燃烧放出的热能转化为电能
B.电解水制取氢气是理想而经济的制氢方法
C.氢氧燃料电池汽车的使用可以有效减少城市空气污染
D.燃料电池的能量转化率可达100%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下反应2AB(g) ![]() A2(g)+B2(g)达到平衡状态的标志是( )
A2(g)+B2(g)达到平衡状态的标志是( )
A.单位时间内生成nmolA2的同时消耗n molAB
B.容器内,3种气体AB、A2、B2共存
C.AB的消耗速率等于A2的消耗速率
D.容器中各组分的体积分数不随时间变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】学过了物质的量浓度的概念后,你认为1 mol/L硫酸溶液的含义应是( )
A.每1 L水中含有1 mol H2SO4
B.每1 L溶液中含1 mol H+
C.将98 g H2SO4溶于1 L水中所配成的溶液
D.指每1 L硫酸溶液中含有98 g H2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示氮及其化合物在一定条件下的转化关系:
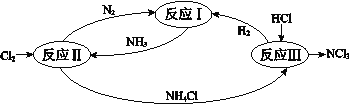
(1)根据反应I,在500℃、20MPa时,将N2和H2通入到体积为2 L的密闭容器中,反应过程中各种物质的物质的量变化如右图所示:

(1)10 min内用NH3表示该反应的平均速率,v(NH3)= 。
(2)在10~20min内NH3浓度变化的原因可能是 (填字母)。
a.加了催化剂
b.降低温度
c.增加NH3的物质的量
(3)该可逆反应达到平衡的标志是_______(填字母)。
a.3v(H2)正 = 2v(NH3)逆
b.混合气体的密度不再随时间变化
c.容器内的总压强不再随时间而变化
d. N2、H2、NH3的分子数之比为1∶3∶2
(4)第一次平衡时,平衡常数K1= (用数学表达式表示)。
(5)反应I:N2(g)+3H2(g)![]() 2NH3(g) ΔH=–92.4 kJmol-1
2NH3(g) ΔH=–92.4 kJmol-1
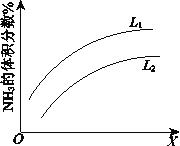
如图所示反应I中平衡混合气中NH3的体积分数随温度或压强变化的曲线,图中L(L1、L2)、X分别代表温度或压强。其中X代表的是____________(填“温度”或“压强”),判断L1、L2的大小关系并说明理由_______ 。
(6)反应II其中一步反应为
2NH3 (g)+3Cl2(g) =N2 (g) +6HCl(g) ΔH=–462 kJmol-1
已知:![]()
断开1 mol H–N键与断开1 mol H–Cl键所需能量相差约为_________ kJ。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com