
【题目】下列溶液加热蒸干后,不能析出原溶质固体的是 ( )
A. Fe2(SO4)3 B. KCl C. FeCl3 D. Na2CO3
 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 1mol 有机物 在一定条件下能和7mol NaOH 反应
在一定条件下能和7mol NaOH 反应
B. 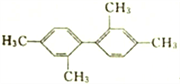 分子中至少有11个碳原子处于同一平面上
分子中至少有11个碳原子处于同一平面上
C. 分子式为C4H7ClO2,可与NaHCO3 产生CO2的有机物的结构可能有3 种
D. 甲烷和Cl2的反应与乙烯和Br2的反应属于同一类型的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用石油裂解产物A可合成多种产物(如F是一种称为富马酸二甲酯的杀菌剂),下图用A合成一些有机产物的转化关系:
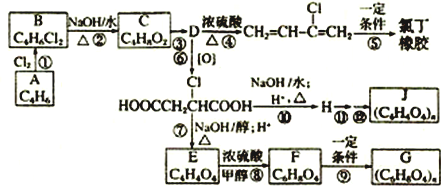
(1)上述反应中属于加成反应的是___________。(填序号)
(2)1H核磁共振谱图表明A分子只有两种化学环境不同的氢原子,红外光谱研究表明A分子中含有两个碳碳双键,请写出D的结构简式: _____________ 。
(3)写出B转化为C的化学方程式__________________________________________。
(4)H物质在浓硫酸存在下可分别生成一种含六元环、七元环、八元环的产物,写出生成六元环产物的化学方程式______________________________________。
(5)写出与A互为同分异构体,且分子中有4个碳原子共直线的有机物的结构简式: ____________。
(6)认真观察合成路线C→E,回答下列两个问题:
a.从C 到E,用了③⑥⑦三步反应,而不是一步进行,这样做的原因是______________。
b.被氧化成HOOC—CH2CHClCOOH的过程中会有中间产物生成,检验该中间产物的试剂是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于硫的说法不正确的是
A. 试管内壁附着的硫可用二硫化碳溶解除去
B. 游离态的硫存在于火山喷口附近或地壳的岩层里
C. 单质硫既有氧化性,又有还原性
D. 硫在过量纯氧中的燃烧产物是三氧化硫
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在实验室可用如图所示装置制取少量乙酸乙酯。有关叙述不正确的是( )

A. 长导管起冷凝、导气的作用
B. 用蒸馏法从所得混合溶液中分离出乙酸乙酯
C. Na2CO3饱和溶液的作用之一是吸收未反应的乙酸
D. 导管末端不插入饱和Na2CO3溶液中是为了防倒吸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科研人员设计一种电化学反应器以Na2SO4溶液为电解质,负载纳米MnO2的导电微孔钛膜和不锈钢为电极材料。这种电催化膜反应器可用于正丙醇合成丙酸,装置示意图:

以下叙述错误的是
A. 微孔钛膜作阴极
B. 使用Na2SO4溶液是为了在电解开始时增强溶液导电性
C. 丙醇转化为丙酸的电极反应式为:CH3CH3CH2OH+H2O-4e-=CH3CH2COOH+4H+
D. 反应器工作时料槽中正丙醇分子向电催化膜移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.其他条件不变时增大压强,能使全气体反应体系中活化分子百分数增加
B.中和反应都是放热反应
C.在FeCl3溶液和KSCN溶液反应的平衡体系中,加入KCl固体,平衡逆向移动
D.熵增大的反应不一定自发,但自发反应熵一定增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳是一种常见的元素,它以多种形式广泛存在于自然界之中。
(1)星际空间存在多种有机分子和无机分子,多数都含有碳元素,C2是一种星际分子,C2和C60互为_______________。
(2)CO2是碳元素重要的氧化物,回答下列有关问题:
①利用CO2与Na2O2反应,可向呼吸面具中提供氧气,其反应方程式为_________________。
②工业上可由CO2和NH3在一定条件下合成尿素,反应方程式为2NH3+CO2![]() CO(NH2)2+H2O当
CO(NH2)2+H2O当![]() 时,CO2的转化率随时间的变化关系如图所示.
时,CO2的转化率随时间的变化关系如图所示.
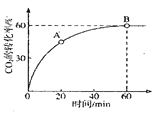
A点的逆反应速率![]() __________B点的正反应速率
__________B点的正反应速率![]() (填“大于“小于”或“等于”),NH3的平衡转化率为____________。
(填“大于“小于”或“等于”),NH3的平衡转化率为____________。
③随着对环境问题认识的深入,CO2的转化捕获问题已成为科研热点之一,以附着纳米银的惰性电极作阴极,可电解CO2转化为CO,装置示意图如下:
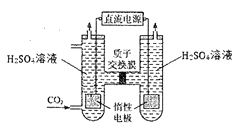
写出通CO2侧电极反应式_________________。
④CO2可用于生产碳酸饮料。苯甲酸钠(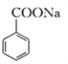 可写为C6H5COONa)也是某些饮料的添加剂,具有抑菌防腐的作用。研究表明苯甲酸(C6H5COOH)的抑菌能力显著高于苯甲酸钠。在生产的某饮料的过程中,除了添加苯甲酸钠外,还需加压充入CO2气体。若忽略碳酸的二级电离,试写出碳酸与苯甲酸钠反应的离子方程式__________________,经计算该反应的化学平衡常数为______________,加压充入CO2后,该饮料的抑菌能力明显增强,结合上述离子方程式分析其原因_______________(已知:H2CO3的Ka1=4.17×10-7;C6H5COOH的Ka=6.25×10-5。)。
可写为C6H5COONa)也是某些饮料的添加剂,具有抑菌防腐的作用。研究表明苯甲酸(C6H5COOH)的抑菌能力显著高于苯甲酸钠。在生产的某饮料的过程中,除了添加苯甲酸钠外,还需加压充入CO2气体。若忽略碳酸的二级电离,试写出碳酸与苯甲酸钠反应的离子方程式__________________,经计算该反应的化学平衡常数为______________,加压充入CO2后,该饮料的抑菌能力明显增强,结合上述离子方程式分析其原因_______________(已知:H2CO3的Ka1=4.17×10-7;C6H5COOH的Ka=6.25×10-5。)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com