
下列说法中正确的是( )
A.石油的分馏和煤的干馏都是物理变化
B.油脂、淀粉、纤维素都是高分子化合物
C.酯类物质是形成水果香味的主要成分
D.纤维素和淀粉互为同分异构体
 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案科目:高中化学 来源:2016-2017学年河北省高二上学期第一次月考化学试卷(解析版) 题型:实验题
利用如图所示装置测定中和热的实验步骤如下:

①用量筒量取50 mL 0.50 mol·L-1盐酸倒入小烧杯中,测出盐酸温度;
②用另一量筒量取50 mL 0.55 mol·L-1 NaOH溶液,并用另一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液最高温度,回答下列问题:
(1)为什么所用NaOH溶液要稍过量?_________________________
(2)倒入NaOH溶液的正确操作是______________(填序号)。
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(3)使盐酸与NaOH溶液混合均匀的正确操作是______________(填序号)。
A.用温度计小心搅拌 B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯 D.用套在温度计上的环形玻璃搅拌棒轻轻地搅动
(4)现将一定量的稀氢氧化钠溶液、稀氢氧化钙溶液、稀氨水分别和1 L 1 mol·L-1的稀盐酸恰好完全反应,其反应热分别为ΔH1、ΔH2、ΔH3,则ΔH1、ΔH2、ΔH3的大小关系为______________。
(5)______________(填“能”或“不能”)用Ba(OH)2溶液和硫酸代替氢氧化钠溶液和盐酸,理由是__________________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广东省高一上学期第一次月考化学试卷(解析版) 题型:选择题
有98g纯H2SO4和纯H3PO4的混酸,测知其中含氧元素65.3%,则混酸中H2SO4和H3PO4的物质的量之比为( )
A.1:1 B.3:1 C.4:1 D.任意比
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广东省高二上学期第一次月考化学试卷(解析版) 题型:选择题
用NA表示阿伏加德罗常数的值,下列叙述中不正确的是( )
①12.4g白磷晶体中含有的P﹣P键数约是0.6NA;
②电解精炼铜时转移了NA个电子,阳极溶解32g铜;
③7.8g Na2S和Na2O2的混合物中含有的阴离子数大于0.1NA;
④2mol SO2和1mol O2混合在V2O5存在的条件下于密闭容器中加热反应后,容器内物质分子数大于2NA;
⑤2.9g 2CaSO4•H2O含有的结晶水分子数为0.02NA (2CaSO4•H2O式量为290);
⑥1molFeCl3与沸水反应生成胶体后,含有NA个Fe(OH)3胶粒;
⑦含0.1mol溶质Na2CO3的溶液中,所含阴离子总数大于0.1NA.
A.①②③④⑤⑦ B.②③⑤⑥ C.①③④⑤⑥ D.③④⑤⑥⑦
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广东省高二上学期第一次月考化学试卷(解析版) 题型:选择题
下列关于自然界中碳循环(如图)的说法中,不正确的是

A.呼吸作用涉及氧化还原反应
B.碳循环具有全球性
C.含碳化合物可相互转化
D.碳元素均被氧化
查看答案和解析>>
科目:高中化学 来源:2017届广东省高三上学期第一次月考化学试卷(解析版) 题型:填空题
恒温恒容条件下,硫可以发生如下转化,其反应过程和能量关系如图1所示。
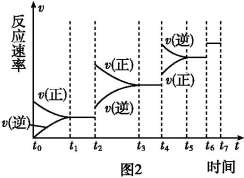
已知:2SO2(g)+O2(g)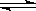 2SO3(g) ΔH=-196.6 kJ/mol。
2SO3(g) ΔH=-196.6 kJ/mol。
请回答下列问题:
(1)写出能表示硫的燃烧热的热化学方程式: 。
(2)状态II到状态III放出的热量为 。
(3)恒温恒容时,1 mol SO2和2 mol O2充分反应,放出热量的数值比∣ΔH2∣ (填“大”、“小”或“相等”)。
(4)将Ⅲ中的混合气体通入足量的NaOH溶液中消耗NaOH的物质的量为 ,若溶液中发生了氧化还原反应,则该过程的离子方程式为: 。
(5)恒容条件下,下列措施中能使n(SO3)/ n(SO2)增大的有 。
A.升高温度
B.充入He气
C.再充入1 mol SO2(g)和1 mol O2(g)
D.使用催化剂
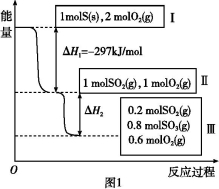
(6)某SO2(g)和O2 (g)体系,时间t1达到平衡后,改变某一外界条件,反应速率v与时间t的关系如图2所示,若不改变SO2(g)和O2(g)的量,则图中t4时引起平衡移动的条件可能是 ;图中表示平衡混合物中SO3的含量最高的一段时间是 。
查看答案和解析>>
科目:高中化学 来源:2017届广东省高三上学期第一次月考化学试卷(解析版) 题型:选择题
NA表示阿伏加德罗常数,下列说法中不正确的是
A.KIO3+6HI=KI+3H2O+3I2 ,生成3mol I2转移电子的总数为5NA
B.标准状况下,5.6 L氧气中含有O的总数为0.5NA
C.25℃时,pH=13的Ba(OH)2溶液1.0L中含有OH-总数为0.1NA
D.20 g重水(D2O)中所含电子总数为8NA
查看答案和解析>>
科目:高中化学 来源:2017届四川省高三上学期入学考试化学试卷(解析版) 题型:选择题
电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如下。下列说法不正确的是( )

A.O2在电极b上发生还原反应
B.溶液中OH-向电极a移动
C.反应消耗的NH3与O2的物质的量之比为4∶5
D.负极的电极反应式为2NH3-6e-+6OH-===N2+6H2O
查看答案和解析>>
科目:高中化学 来源:2017届湖北省高三上学期开学考试化学试卷(解析版) 题型:填空题
现有反应:mA(g)+nB(g) 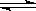 pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
(1)该反应的逆反应为________热反应,且m+n______p (填“>”、“=”或“<”) 。
(2)减压时,A的质量分数__________。(填“增大”、“减小”或“不变”,下同)
(3)若容积不变加入B,则B的转化率__________。
(4)若升高温度,则平衡时B、C的浓度之比将__________。
(5)若加入催化剂,平衡时气体混合物的总物质的量__________。
(6)若B是有色物质,A、C均无色,则加入C(体积不变)时混合物颜色__________;而维持容器内压强不变,充入氖气时,混合物颜色 。(填“变深”、“变浅”或“不变”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com