

分析 (1)C装置中是固体亚硫酸钠和浓硫酸反应生成二氧化硫气体;
(2)①验证还原性Fe2+>Cl-是利用装置中的反应,还原剂的还原性大于还原产物,可以先再A装置制备氯气通入B装置的氯化亚铁溶液中发生反应,溶液变化浅绿色为黄色溶液;
②验证还原性SO2>Fe2+是利用装置C制备二氧化硫气体,通入装置B中的氯化铁溶液中,溶液由黄色变化为浅绿色,氯化铁被二氧化硫还原生成氯化亚铁,氧化还原反应中还原剂还原性大于还原产物;
(3)检验硫酸根离子的实验方法是加入盐酸、氯化钡,观察是否有白色沉淀生成设计实验.
解答 解:(1)KClO3中Cl元素化合价由+5价变成0价,化合价降低5价,HCl中氯元素化合价由-1价升高为0价,反应方程式为:KClO3+6HCl═KCl+3Cl2↑+3H2O,改成离子方程式为:ClO3-+5Cl-═3Cl2↑+3H2O;
C装置中是固体亚硫酸钠和浓硫酸反应生成二氧化硫气体,反应的离子方程式为:SO32-+H2SO4(浓)=SO42-+SO2↑+H2O,
故答案为:ClO3-+5Cl-═3Cl2↑+3H2O;SO32-+H2SO4(浓)=SO42-+SO2↑+H2O;
(2)①验证还原性Fe2+>Cl-是利用装置中的反应,还原剂的还原性大于还原产物,可以先再A装置制备氯气通入B装置的氯化亚铁溶液中发生反应,溶液变化浅绿色为黄色溶液,操作是关闭K1 、K3、K4,打开K2、分液漏斗活塞a,发生反应Cl2+2Fe2+=2Fe3++2Cl-,依据现象和反应判断,还原剂Fe2+的还原性大于还原产物Cl-,
故答案为:关闭K1 、K3、K4,打开K2、分液漏斗活塞a;
②验证还原性SO2>Fe2+是利用装置C制备二氧化硫气体,通入装置B中的氯化铁溶液中,溶液由黄色变化为浅绿色,氯化铁被二氧化硫还原生成氯化亚铁,2Fe3++SO2+H2O=2Fe2++2H++SO42-,氧化还原反应中还原剂SO2还原性大于还原产物Fe2+,操作为:关闭K1 、K2、K4,打开K3、分液漏斗活塞b,
故答案为:关闭K1 、K2、K4,打开K3、分液漏斗活塞b;
(3)检验硫酸根离子的实验方法是加入盐酸、氯化钡,观察是否有白色沉淀生成设计实验,实验结束时,检验实验后的B中溶液是否含有SO42-的操作方法为:打开旋塞b,放出少量溶液于D中,加入盐酸无现象,加入氯化钡溶液生成白色沉淀是硫酸钡沉淀,证明原溶液中含硫酸根离子,
故答案为:打开旋塞b,放出少量溶液于D中,加入盐酸无现象,加入氯化钡溶液生成白色沉淀是硫酸钡沉淀,证明原溶液中含硫酸根离子.
点评 本题考查了物质制备、物质检验、氧化还原反应中还原性强弱比较的实验设计步骤和反应原理,注意装置中活塞开关的作用,题目难度中等,试题培养了学生的分析能力及化学实验能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 用酸性KMnO4溶液鉴别CH3CH3和CH2=CH2 | |
| B. | 将盛有等体积CH4和Cl2的大试管倒扣在水槽中光照,试管内不能充满液体 | |
| C. | 用NaOH溶液除去乙酸乙酯中的少量乙酸 | |
| D. | 用NaOH溶液和新制Cu(OH)2悬浊液检验淀粉在稀H2SO4作用下是否水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在Na2B溶液中一定有:c(OH-)=c(H+)+c(HB-)+2c(H2B) | |
| B. | NaHB溶液可能存在以下关系:c(Na+)>c(HB-)>c(OH-)>c(H+) | |
| C. | NaHB水溶液中一定有:c(Na+)+c(H+)=c(HB-)+c(OH-)+c(B2-) | |
| D. | NaHB溶液一定呈酸性,Na2B溶液一定呈碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ②③④ | C. | ②③⑤ | D. | ①③⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.2mol•L-1的Na2CO3溶液中离子浓度关系:c (Na+)=2c (CO32-)+c (HCO3-)+c (H2CO3) | |
| B. | 0.01mol•L-1的NH4Cl和0.01mol•L-1的NH3•H2O等体积混合后,若测得溶液中c (Cl-)>c (NH4+),则溶液中有关微粒的浓度关系: c (Cl-)>c (NH3•H2O)>c (NH4+)>c (H+)>c (OH-) | |
| C. | 0.1mol的NaHS和0.1mol的NaHSO4混合溶于水,配制成1L溶液,则混合溶液中离子浓度关系为:c (Na+)-0.1mol•L-1=2c (S2-)+c (H2S)+c (HS-) | |
| D. | 0.1mol•L-1的NaHCO3溶液中离子浓度关系:c (OH-)=c (H+)+c (H2CO3)-c (CO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定含有I- | B. | 一定含有CO32- | C. | 一定含有NH4+ | D. | 一定含有Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向某溶液中滴加NaOH溶液并加热,用湿润的蓝色石蕊试纸于试管口以检验NH4+ | |
| B. | 加入氯化钡溶液有白色沉淀产生,再加入盐酸,沉淀不消失,一定有SO42- | |
| C. | 某待测液焰色反应呈黄色,则待测液中一定不含有K+ | |
| D. | 某溶液中加入KSCN后,溶液无变化,再加入H2O2后,溶液变成血红色,说明原溶液中一定含有Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
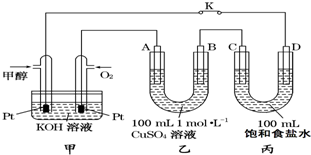 如图是甲醇(CH3OH)燃料电池工作的示意图,其中A、B、D均为石墨电极,C为铜电极.工作一段时间后,断开K,此时A、B两极上产生的气体体积相同.
如图是甲醇(CH3OH)燃料电池工作的示意图,其中A、B、D均为石墨电极,C为铜电极.工作一段时间后,断开K,此时A、B两极上产生的气体体积相同.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com