
【题目】SO2 是危害最为严重的大气污染物之一,SO2 的含量是衡量大气污染的一个重要指标。工业上常采用催化还原法或吸收法处理 SO2。催化还原 SO2 不仅可以消除 SO2 污染,而且可得到有价值的单质S。
(1)在复合组分催化剂作用下,CH4 可使 SO2 转化为 S,同时生成 CO2 和 H2O。已知 CH4 和 S的燃烧热分别为 890.3 kJ /mol 和 297.2 kJ /mol , CH4 和 SO2 反应的热化学方程式为__________。
(2)用 H2 还原 SO2 生成S 的反应分两步完成,如图 1 所示,该过程中相关物质的物质的量浓度随时间的 变化关系如图 2 所示:

①分析可知X 为______写化学式),0~t1 时间段的温度为_____,0~t1 时间段用SO2 表示的化学反应速率为_____。
②总反应的化学方程式为____________。
【答案】CH4 (g)+2SO2 (g)=== CO2 (g)+2S (s)+2H2O(l) △H= -295.9 kJ/mol H2S 300℃ 2×10-3/t1 mol/(L·min) 2H2+SO2=S+2H2O
【解析】
(1)已知CH4和S的燃晓熱分別为890.3kJ/mol和297.2kJ/mol,则有
①CH4(g)+2O2(g)=CO2(g)+2H2(g)△H=-890.3kJ/mol
②S(g)+O2(g)=SO2(g)△H=-297.2 kJ/mol
根据盖斯定律可知①-②×2即得到CH4和SO2反应的热化学方程式为CH4(g)+2SO2(g)=CO2(g)+2S(g)+2H2O(l) △H=-295.9kJ/mol;
(2)①氢气与二氧化硫反应生成X,X与SO2反应生成S,反应中X是还原剂,则X为H2S。0~t1时间内主要是生成X,则反应的温度为300℃,0~t1时间段二氧化硫浓度减少0.002mol/L,则用SO2表示的化学反应速率为![]() =2×10-3mol/( Lmin);
=2×10-3mol/( Lmin);
②根据原子守恒可知反应中还有水生成,则总反应的化学方程式为2H2+SO2=S+2H2O。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列化学反应的离子方程式中正确的是( )
A. 盐酸与碳酸钡反应:CO32-+2H+ = CO2↑+H2O
B. 硫酸铜溶液中滴加氢氧化钡溶液:Ba2++SO42-= BaSO4↓
C. 澄清石灰水与少量小苏打溶液混合:Ca2+ + OH-+ HCO3-= CaCO3↓ + H2O
D. 向沸水中滴加FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O![]() Fe(OH)3↓+3H+
Fe(OH)3↓+3H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】叠氮酸钠(NaN3)是汽车安全气囊的产气剂,Fe2O3是主氧化剂,NaHCO3作冷却剂。当汽车发生剧烈碰撞时,分解产生大量气体使安全气囊迅速打开,从而起到安全保护作用[已知Ka(HN3)=1.8×10-5]。下列有关说法正确的是
A. NaHCO3的冷却原理是它发生分解,消耗体系的热量
B. Fe2O3和Na反应的氧化产物是Na2O2
C. 等物质的量的NaN3和HN3混合溶液显碱性
D. 若有6.5 gNaN3分解产生N2,则转移0.9 mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中含有以下离子中的若干种:K+、Cl-、NH、Mg2+、CO![]() 、Ba2+、SO
、Ba2+、SO![]() 。现取3份该溶液各100 mL分别进行如下实验:
。现取3份该溶液各100 mL分别进行如下实验:
实验序号 | 实验内容 | 实验结果 |
① | 加AgNO3溶液 | 有白色沉淀生成 |
② | 加足量NaOH溶液并加热 | 收集到气体,在标准状况下体积为2.24 L |
③ | 加足量BaCl2溶液,对所得沉淀进行洗涤、干燥、称量;再向沉淀中加足量稀盐酸,然后干燥、称量 | 第一次称量读数为12.54 g,第二次称量读数为4.66g |
试回答下列问题:
(1)根据实验①对Cl-是否存在的判断是_______________(填“一定存在”“一定不存在”或“不能确定”);根据实验①~③判断混合物中一定不存在的离子是___________。
(2)试确定溶液中一定存在的阴离子及其物质的量浓度(可不填满):
阴离子符号 | 物质的量浓度(mol/L) |
__________ | |
(3)试确定K+是否存在 __________ (填“是”或“否”),判断的理是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室里常用浓盐酸与二氧化锰反应来制取少量的氯气,反应的化学方程式为 MnO2 + 4HCl (浓)![]() MnCl2+ Cl2↑ +2H2O ,欲制得标准状况下4.48L氯气,
MnCl2+ Cl2↑ +2H2O ,欲制得标准状况下4.48L氯气,
(1)参加反应的HCl的质量是 __________ 克
(2)反应中实际被氧化的HCl的物质的量是__________ mol
(3)反应中转移的电子个数为 ______________ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2气体是安全、无毒的绿色消毒剂和保鲜剂,使用中不产生致癌物及二次污染物。某化学兴趣小组通过下图对其吸收、释放进行研究,请回答以下问题:
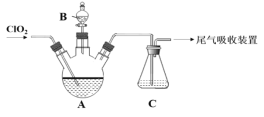
(1)用KClO3与Na2SO3在H2SO4酸化时制取ClO2,该反应的离子方程式为______。
(2)如图A中盛放有Na2CO3-H2O2混合溶液,常用于ClO2的吸收稳定剂。已知ClO2被稳定剂吸收生成NaClO2,若C中淀粉KI-H2SO4溶液变蓝,_____(填“能”或“不能”) 说明在仪器A中ClO2被完全吸收。
(3)已知ClO2的消毒能力是等物质的量Cl2的2.5倍,则ClO2在将含氰废液中的CN-氧化成CO2和N2的反应中,氧化剂和还原剂的物质的量之比为______。
(4)由B向A中滴加稀盐酸即可释放出ClO2,此时C的作用是_____。已知ClO2能被多种稳定剂所吸收,若将ClO2用于果蔬保鲜,图中吸收效果较好的稳定剂是___(填 “Ⅰ”或“Ⅱ”),原因是______。

(5)ClO2的“有效氯”可通过标定反应后溶液中的残氯[c(Cl-)]来测定。在分析化学中以K2CrO4为指示剂,用AgNO3标准溶液滴定溶液中的Cl-,当出现砖红色沉淀时,即指示达滴定终点。若保证溶液中c(Cl-)降为1.0×10-5 mol/L,则此时溶液中c(CrO42-)应不超过______mol/L。[Ksp(AgCl)=2.0×10-10,Ksp(Ag2CrO4)=2.0×10-12]。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述错误的是( )
A. 电镀时,待镀的金属制品作阳极
B. 用惰性电极电解CuSO4溶液,溶液pH增大
C. 氢氧燃料电池(酸性电解质)中,正极反应为O2+4H++4e﹣=2H2O
D. 镀锌铁皮比镀锡铁皮耐腐蚀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com