
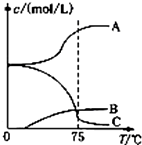
 氯酸钠(NaClO3)是无机盐工业的重要产品之一.
氯酸钠(NaClO3)是无机盐工业的重要产品之一.分析 (1)石灰乳与氯气反应生成氯化钙和氯酸钙,除去氯化钙后,可加入碳酸钠溶液,以生成碳酸钙沉淀,以此得到氯酸钠;
(2)氯气与氢氧化钠反应温度低时生成NaClO,温度高时生成NaC1O3;
(3)采用无隔膜电解饱和食盐水法生产氯酸钠,同时生成氢气;
(4)①酸性条件下,亚铁离子被ClO3-氧化为铁离子,自身被还原为氯离子;静置10min可以使反应进行完全;
②K2Cr2O7溶液具有强氧化性,能腐蚀碱式滴定管的橡胶管;
③K2Cr2O7具有氧化性,与亚铁离子反应,可确定步骤②消耗的(NH4)2Fe(SO4)2的量;
④如果溶液中的Fe2+被空气中的氧气,在滴定时消耗的(NH4)2Fe(SO4)2溶液会偏多.
解答 解:(1)热的石灰乳通入氯气,反应的方程式为:2Cl2+2Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+Ca(ClO)2+2H2O,除去CaCl2后主要成分为Ca(ClO)2,要加入钠盐得到NaClO3,应加入Na2CO3,发生复分解反应生成碳酸钙沉淀,
故答案为:Na2CO3;
(2)氯气与氢氧化钠反应温度低时生成NaClO,温度高时生成NaC1O3,图中C的浓度随着温度的升高而减小,所以C代表ClO-;
故答案为:ClO-;
(3)采用无隔膜电解饱和食盐水法生产氯酸钠,阳极发生氧化反应,电极方程式为Cl--6e-+6OH-=C1O3-+3H2O,故答案为:Cl--6e-+6OH-=C1O3-+3H2O;
(4)①酸性条件下,亚铁离子被ClO3-氧化为铁离子,自身被还原为氯离子,其反应的离子方程式为:ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O,静置10min可以使亚铁离子和ClO3-充分反应,
故答案为:ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;使溶液中C1O3-与Fe2+反应充分完全;
②K2Cr2O7溶液具有强氧化性,能腐蚀碱式滴定管的橡胶管,所以应该用酸式滴定管盛放;
故答案为:酸式滴定管;
③K2Cr2O7具有氧化性,与亚铁离子反应,可确定步骤②消耗的(NH4)2Fe(SO4)2的量,故答案为:计算步骤②消耗的(NH4)2Fe(SO4)2的量;
④如果溶液中的Fe2+被空气中的氧气,则溶液中Fe2+的浓度会减小,在滴定时消耗的(NH4)2Fe(SO4)2溶液的体积会偏大,所以测定的结果偏高;
故答案为:溶液中的Fe2+被空气中的氧气氧化.
点评 本题以氯酸盐的制备为载体考查物质的分离、提纯以及含量的测定、氧化还原反应滴定法的应用等,侧重于学生的分析、实验能力的考查,注意把握物质的性质为解答该题的关键,题目难度中等.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向AgI中加一定浓度、一定体积的NaCl溶液,AgI可转化为AgCl | |
| B. | 常温下,AgCl若要在NaI溶液中开始转化为AgI,则NaI的浓度应该大于$\frac{1}{\sqrt{1.8}}$×10-11mol/L | |
| C. | AgI比AgCl更难溶于水,AgCl可以转化为AgI | |
| D. | 向c(Ag+)=1.8×10-4mol/L的溶液中加入等体积NaCl溶液,开始出现AgCl沉淀,则NaCl溶液浓度应大于1.0×10-6mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向饱和AgCl水溶液中加入少量的NaCl固体,Ksp(AgCl)变大 | |
| B. | AgNO3溶液与NaCl溶液混合后的溶液中,一定有c(Ag+)=c(Cl-) | |
| C. | 25℃时,当溶液中c(Ag+)×c(Cl-)=Ksp(AgCl)时,此溶液为AgCl的饱和溶液 | |
| D. | 将固体AgCl加入到浓KI溶液中,部分AgCl转化为AgI,故AgCl溶解度小于AgI |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
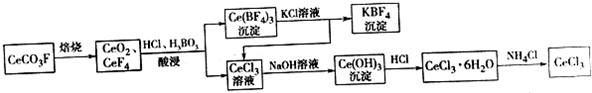
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
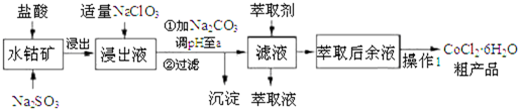
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
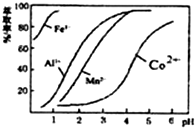
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知酸性高锰酸钾溶液是常用的强氧化剂,可以和草酸钠、二氧化硫等还原性物质发生氧化还原反应.
已知酸性高锰酸钾溶液是常用的强氧化剂,可以和草酸钠、二氧化硫等还原性物质发生氧化还原反应.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com