
将0.1mol·L-1的下列物质的水溶液,从常温加热到90 ℃,溶液的pH不变的是( )
A.氯化钠 B.硫酸
C.氢氧化钾 D.硫酸铵
 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:
糖类、脂肪和蛋白质是维持人体生命活动所必需的三大营养物质。以下叙述正确的是( )
A.植物油不能使溴的四氯化碳溶液褪色
B.葡萄糖能发生氧化反应和水解反应
C. 淀粉和纤维素水解的最终产物是葡萄糖
淀粉和纤维素水解的最终产物是葡萄糖
D.蛋白质溶液遇硫酸铜后产生的沉淀能重新溶于水
查看答案和解析>>
科目:高中化学 来源: 题型:
某物质的结构为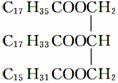 ,关于该物质的叙述正确的是 ( )
,关于该物质的叙述正确的是 ( )
A.一定条件下与氢气反应可以生成硬脂酸甘油酯
B.一定条件下与氢气反应可以生成软脂酸甘油酯
C.与氢氧化钠溶液混合加热能得到肥皂的主要成分
D.与其互为同分异构体且完全水解后产物相同的油脂有三种
查看答案和解析>>
科目:高中化学 来源: 题型:
某学习小组探究浓、稀硝酸氧化性的相对强弱,按下图装置进行实验(夹持仪器已略去)。
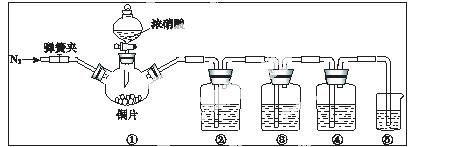
可选药品:稀硝酸、浓硝酸、浓硫酸、NaOH 溶液、蒸馏水
溶液、蒸馏水
查阅资料:
A.浓硝酸能将NO氧化成NO2,而稀硝酸不能氧化NO。
B.氢氧化钠溶液不与NO反应,能与NO2反应2NO2 + 2NaOH = NaNO3 + NaNO2 +H2O
| 实验过程 | 实验现象 |
| I.检验装置的气密性 | |
| II.…… | |
| III.打开分液漏斗活塞,将浓硝酸缓慢滴入烧瓶中,关闭活塞。 | ①中产生大量的红棕色气体,红棕色气体在②中变为无色,气体通过③后依然为无 |
(1)①中发生反应的离 子方程式是 。
子方程式是 。
(2)②中发生反应的化学方程式是 。
(3)装置②~⑤中盛放的药品分别是②  、③ 、④ 、⑤
、③ 、④ 、⑤  。
。
(4)II的操作是 ,目的是 。
(5)该同学得出结论 所依据的实验现象是 。
所依据的实验现象是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
pH相同的氨水、NaOH和Ba(OH)2溶液,分别用蒸馏水稀释到原来的X、Y、Z倍,稀释后三种溶液的pH仍然相同,则X、Y、Z的关系是( )
A.X=Y=Z B.X>Y=Z
C.X<Y=Z D.X=Y<Z
查看答案和解析>>
科目:高中化学 来源: 题型:
若室温下0.1mol·L-1NaX溶液中pH=9,则该溶液中发生水解反应的X-占全部X-的( )
A.0.01% B. 0.09%
C.1.0% D.无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上制备BaCl2的工艺流程图如下:
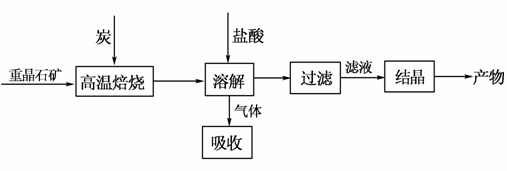
某研究小组在实验室用重晶石(主要成分BaSO4)对工业过程进行模拟实验。查表得
BaSO4(s)+4C(s)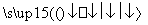 4CO(g)+BaS(s)
4CO(g)+BaS(s)
ΔH1=+571.2 kJ·mol-1 ①
BaSO4(s)+2C(s)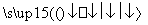 2CO2(g)+BaS(s)
2CO2(g)+BaS(s)
ΔH2=+226.2 kJ·mol-1 ②
(1)气体用过量NaOH溶液吸收,得到硫化钠。Na2S水解的离子方程式为________________________________________________。
(2)反应C(s)+CO2(g)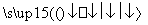 2CO(g)的ΔH=________kJ·mol-1。
2CO(g)的ΔH=________kJ·mol-1。
(3)实际生产中必须加入过量的炭,同时还要通入空气,其目的是______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某同学欲从溶有苯酚的乙醇中回收苯酚,设计了实验方案,其流程如下,试回答下列问题。
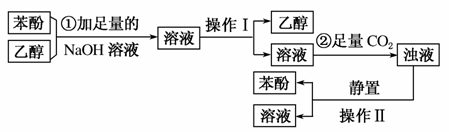
(1)①中加入NaOH溶液后发生的化学反应方程式:__________________________________________。
(2)操作Ⅰ为________,操作Ⅱ为________。
(3)②中通入CO2后发生的化学反应方程式为:____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
合成氨是人类科学技术上的一项重大突破,其反应原理为:
N2(g)+3H2(g)2NH3(g)
ΔH=-92.4 kJ·mol-1
一种工业合成氨的简易流程图如下:
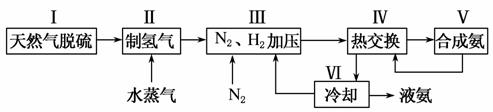
(1)天然气中的H2S杂质常用氨水吸收,产物为NH4HS。一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式_____________________________________________________ _____________________________________________________________________________________。
(2)步骤Ⅱ中制氢气原理如下:
①CH4(g)+H2O(g)CO(g)+3H2(g)
ΔH=+206.4 kJ·mol-1
②CO(g)+H2O(g)CO2(g)+H2(g)
ΔH=-41.2 kJ·mol-1
对于反应①,一定可以提高平衡体系中H2百分含量,又能加快反应速率的措施是________(填选项字母)。
a.升高温度 b.增大水蒸气浓度
c.加入催化剂 d.降低压强
利用反应②,将CO进一步转化,可提高H2产量。若1 mol CO和H2的混合气体(CO的体积分数为20%)与H2O反应,得到1.18 mol CO、CO2和H2的混合气体,则CO转化率为______________________ __________________________________________________。
(3)图1表示500 ℃、60.0 MPa条件下,原料气投料比与平衡时NH3体积分数的关系。根据图中a点数据计算N2的平衡体积分数为________。
(4)依据温度对合成氨反应的影响,在图2坐标系中,画出一定条件下的密闭容器内,从通入原料气开始,随温度不断升高,NH3物质的量变化的曲线示意图。
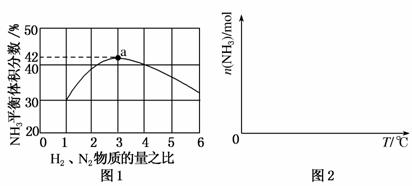
(5)上述流程图中,使合成氨放出的能量得到充分利用的主要步骤是(填序号)________。简述本流程中提高合成氨原料总转化率的方法________________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com