
| A. | ①② | B. | ①②③ | C. | ①②③④ | D. | ②③④ |
分析 ①碳酸不能与强酸盐BaCl2反应生成强酸和弱酸盐;
②石灰水与CO2反应生成碳酸钙沉淀;
③碳酸钠与二氧化碳和水反应生成溶解度较小的NaHCO3;
④CO2与K2SiO3反应生成硅酸.
解答 解:①因酸与盐反应一般规律是:强酸与弱酸盐反应生成弱酸和强酸的盐.像本选项中碳酸不能与强酸盐BaCl2反应生成强酸和弱酸盐,所以自始至终也不出现浑浊,故①错误;
②石灰水与少量CO2反应生成碳酸钙沉淀,故②正确;
③因碳酸钠与二氧化碳和水反应生成溶解度较小的NaHCO3,溶剂水减少,生成的碳酸氢钠质量比碳酸钠多,故最终有碳酸氢钠析出而使溶液变浑浊,故③正确;
④CO2与K2SiO3反应生成硅酸,生成沉淀,故④正确.
故选D.
点评 本题考查了CO2的相关性质,酸与盐反应一般规律是:强酸与弱酸盐反应生成弱酸和强酸的盐.但要注意在酸与盐反应的问题上有些特例,如CuSO4+H2S═CuS↓+H2SO4.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业上常以海带或其它海产品为原料提取碘 | |
| B. | 炼铁和制玻璃的工业中都要用到石灰石 | |
| C. | 氯气通入石灰乳中制漂白粉 | |
| D. | 电解氯化钠溶液制金属钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
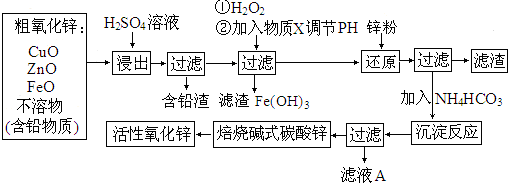
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| T/℃ | 165 | 175 | 185 | 195 |
| K | 111.9 | 74.1 | 50.6 | 34.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③⑤ | B. | ②③④ | C. | ①②③ | D. | ①②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
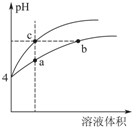 为了证明一水合氨(NH3•H2O)是弱电解质,甲、乙二人分别选用下列试剂进行实验:氨水、0.10mol•L-1NH4Cl溶液、NH4Cl晶体、酚酞试液、pH试纸、蒸馏水.
为了证明一水合氨(NH3•H2O)是弱电解质,甲、乙二人分别选用下列试剂进行实验:氨水、0.10mol•L-1NH4Cl溶液、NH4Cl晶体、酚酞试液、pH试纸、蒸馏水.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com