
 往20mL硫酸和盐酸的混合溶液中,加入0.05mol/LBa(OH)2溶液时,生成BaSO4的量和溶液的pH变化如图.试回答:
往20mL硫酸和盐酸的混合溶液中,加入0.05mol/LBa(OH)2溶液时,生成BaSO4的量和溶液的pH变化如图.试回答:| 1 |
| 1 |
| x |
| 0.02L×0.05mol/L |
| 0.001mol |
| 0.02L |
| 0.004mol |
| 0.02L |
| 0.2mol/L×0.02L |
| 0.02L+0.02L |


科目:高中化学 来源:2012-2013学年河南省偃师高级中学高二下学期第二次月考化学试(带解析) 题型:填空题
往20mL硫酸和盐酸的混合溶液中,加入0.05mol/LBa(OH)2溶液时,生成BaSO4的量和溶液的pH变化如右图。试回答: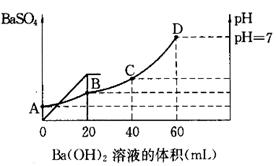
(1)起始时,混酸中H2SO4的物质的量浓度为
(2)起始时,混酸中盐酸的物质的量浓度为
(3)B点时溶液的pH是 。
查看答案和解析>>
科目:高中化学 来源:2014届河南省高二下学期第二次月考化学试(解析版) 题型:填空题
往20mL硫酸和盐酸的混合溶液中,加入0.05mol/LBa(OH)2溶液时,生成BaSO4的量和溶液的pH变化如右图。试回答:
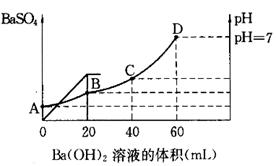
(1)起始时,混酸中H2SO4的物质的量浓度为
(2)起始时,混酸中盐酸的物质的量浓度为
(3)B点时溶液的pH是 。
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
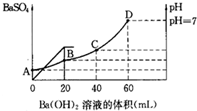 往20mL硫酸和盐酸的混合溶液中,加入0.05mol/L Ba(OH)2溶液时,生成BaSO4的量和溶液的pH变化如图.试回答:
往20mL硫酸和盐酸的混合溶液中,加入0.05mol/L Ba(OH)2溶液时,生成BaSO4的量和溶液的pH变化如图.试回答:查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
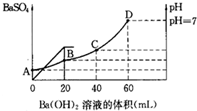
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com