
【题目】某溶液中含有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() ,向该溶液中通入过量的
,向该溶液中通入过量的![]() ,下列判断正确的是( )
,下列判断正确的是( )
①反应前后,溶液中离子浓度基本保持不变的有![]() 、
、![]() ;②有胶状物质生成;③有气体产生;④溶液颜色发生变化;⑤共发生了2个氧化还原反应.
;②有胶状物质生成;③有气体产生;④溶液颜色发生变化;⑤共发生了2个氧化还原反应.
A.①③⑤B.①②③C.②③④D.②④⑤
【答案】C
【解析】
某溶液中含有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() ,向该溶液中通入过量的Cl2,Cl2与水反应;SO32-可以被氯气氧化为硫酸根离子;SiO32-和氯水中的盐酸反应生成硅酸沉淀;Br-被氯气氧化为溴单质;CO32-和氯水中的盐酸反应生成二氧化碳气体,据此分析解答。
,向该溶液中通入过量的Cl2,Cl2与水反应;SO32-可以被氯气氧化为硫酸根离子;SiO32-和氯水中的盐酸反应生成硅酸沉淀;Br-被氯气氧化为溴单质;CO32-和氯水中的盐酸反应生成二氧化碳气体,据此分析解答。
某溶液中含有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() ,向该溶液中通入过量的Cl2,SO32可以被氯气氧化为硫酸根离子;SiO32和氯水中的盐酸反应生成硅酸沉淀;Br被氯气氧化为溴单质;CO32和氯水中的盐酸反应生成二氧化碳气体;
,向该溶液中通入过量的Cl2,SO32可以被氯气氧化为硫酸根离子;SiO32和氯水中的盐酸反应生成硅酸沉淀;Br被氯气氧化为溴单质;CO32和氯水中的盐酸反应生成二氧化碳气体;
①因钠离子与溶液中其它微粒不反应,所以反应前后浓度保持不变;SO32可以被氯气氧化为SO42,所以SO42浓度变大,故①错误;
②根据以上分析可知,有胶状物质硅酸生成,故②正确;
③碳酸根离子与氯化氢反应生成二氧化碳气体,所以有气体产生,故③正确;
④氯气氧化溴离子为溴单质,溶液颜色发生变化,由无色变化为橙红色,故④正确;
⑤SO32和Br-被氧化,且氯气和水反应也是氧化还原反应,所以共发生了3个氧化还原反应,故⑤错误;故②③④正确;
故选C。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】铁被誉为“第一金属”,铁及其化合物在生活中有广泛应用
(1)基态Fe3+的电子排布式为________。
(2)实验室用KSCN溶液、苯酚(![]() )检验Fe3+。N、O、S的第一电离能由大到小的顺序为_______(用元素符号表示),苯酚中碳原子的杂化轨道类型为______。
)检验Fe3+。N、O、S的第一电离能由大到小的顺序为_______(用元素符号表示),苯酚中碳原子的杂化轨道类型为______。
(3)FeCl3的熔点为306℃,沸点为315℃ FeCl3的晶体类型是______。FeSO4常作补铁剂,SO42-的立体构型是_______。
(4)基铁[Fe(CO)5]可用作催化剂、汽油抗爆剂等,1 mol Fe(CO)5分子中含σ键数目为_______,与CO互为等电子体的离子是__________(填化学式,写一种)
(5)氮化铁晶体的晶体结构示意图如图1所示。该晶体中铁、氮的微粒个数之比为______。
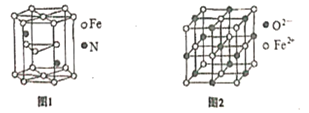
(6)氧化亚铁晶体的晶胞如图2所示。已知:氧化亚铁晶体的密度为ρg·cm-1,NA代表阿伏加德罗常数的值。在该晶胞中,与Fe2+紧邻且等距离的Fe2+数目为_____;Fe2+与O2-的最短间距为_______ pm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种待测浓度的H2SO4溶液20 mL,加入10 mL 0.5 mol/L BaCl2溶液,恰好完全反应。
(1)得到BaSO4沉淀多少克?____________
(2)待测H2SO4溶液的物质的量浓度是多少?______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一种利用锂电池“固定CO2”的电化学装置,在催化剂的作用下,该电化学装置放电时可将CO2转化为C和Li2CO3,充电时选用合适催化剂,仅使Li2CO3发生氧化反应释放出CO2和02。下列说法中正确的是

A. 该电池充电时,阳极反应式为:C+2Li2CO3-4e-=3CO2↑+4Li
B. 该电池放电时,Li+向电极X方向移动
C. 该电池充电时,电极Y与外接直流电源的负极相连
D. 该电池放电时,每转移4mol电子,理论上生成1molC
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高锰酸钾、高铬酸是一种典型的强氧化剂。完成下列填空:
(1)某一反应体系有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2 已知该反应中H2O2只发生如下过程:H2O2→O2
①该反应中的还原剂是_____________。
②该反应中,发生还原反应的过程是____________→__________。
③写出该反应的化学方程式_______________________。
(2)在用KMnO4酸性溶液处理Cu2S和CuS的混合物时,发生的反应如下:
①MnO4-+Cu2S+H+→Cu2++SO2↑+Mn2++H2O(未配平)
②MnO4-+CuS+H+→Cu2++SO2↑+Mn2++H2O(未配平)
下列关于反应①的说法中正确的是______________(填字母序号)。
a.被氧化的元素是Cu和S
b.氧化剂与还原剂的物质的量之比为8∶5
c.生成2.24 L(标况下)SO2,反应转移电子的物质的量是0.8 mol
d.还原性的强弱关系是:Mn2+>Cu2S
(3)在稀硫酸中,![]() 和H2O2也能发生氧化还原反应。
和H2O2也能发生氧化还原反应。
已知:2KMnO4+7H2O2+3H2SO4===K2SO4+2MnSO4+6O2↑+10H2O,则被2 mol KMnO4氧化的H2O2是____________mol。
(4)高锰酸钾溶液与硫化亚铁固体有如下反应:
10FeS+6KMnO4+24H2SO4===3K2SO4+6MnSO4+5Fe2(SO4)3+10S+24H2O
若上述反应前后固体的质量减少了2.8 g,则硫元素与KMnO4之间发生电子转移的数目为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 是火箭的固体燃料,发生反应为
是火箭的固体燃料,发生反应为![]() ,下列说法正确的是( )
,下列说法正确的是( )
A.![]() 溶于水电离方程式为
溶于水电离方程式为![]()
B.反应中还原产物分子数与氧化产物分子总数之比为1∶3
C.产生![]() 反应转移的电子总数为
反应转移的电子总数为![]()
D.![]() 分解产生的气体体积为44.8L
分解产生的气体体积为44.8L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是由常见元素组成的一些单质及其化合物之间的转化关系图。各方框中的字母表示一种反应物或生成物(部分物质,反应条件已经略去)。其中A、B、D在常温下均为无色无味的气体,C是能使湿润的红色石蕊试纸变蓝的气体,M是最常见的无色液体。
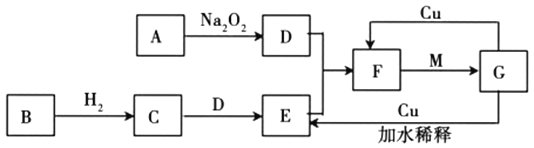
(1)写出![]() 的化学方程式:_______________________。
的化学方程式:_______________________。
(2)实验室常用加热两种固体混合物的方法制备物质C,其化学方程式为_________,干燥C常用_______________(填写试剂名称)。
(3)E物质遇到D物质时,会观察到_______________________现象,若用排水法收集F,则最终集气瓶中收集到的气体为____________________(写化学式)。
(4)写出![]() 的离子反应方程式_________________________。
的离子反应方程式_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对各电解质溶液的分析正确的是( )
A.硫酸铁溶液中能大量共存的离子:K+、Na+、NO3-、CO32-
B.Ca(HCO3)2溶液与过量NaOH溶液反应:HCO3-+Ca2++OH-=CaCO3↓+H2O
C.0.1molL﹣1Na2S溶液中存在:c(OH-)=c(H+)+c(HS﹣)+2c(H2S)
D.NH4HSO4溶液呈酸性的主要原因是:NH4++H2O![]() NH3H2O+H+
NH3H2O+H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.4g NaOH和1.06g Na2CO3混合并配成溶液,向溶液中滴加0.1mol·L-1稀盐酸。下列图像能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是( )
A. B.
B.
C. D.
D.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com