
| A、1mol O2所含的原子数目为NA |
| B、0.5mol H2O的质量为9g |
| C、16g CH4分子含有的电子数目为NA |
| D、标准状况下,11.2L氢气含有分子的物质的量是0.5mol |
| m |
| M |
| m |
| M |
| V |
| Vm |
| 16g |
| 16g/mol |
| 11.2L |
| 22.4L/mol |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
A、按系统命名法,化合物 的名称为2,4-二甲基-5-丙基庚烷 的名称为2,4-二甲基-5-丙基庚烷 |
| B、人们生活中经常接触的聚乙烯、聚氯乙烯、聚苯乙烯、ABS工程塑料、顺丁橡胶等制品都是通过加聚反应得到的 |
| C、若两种二肽互为同分异构体,则二者的水解产物一定不相同 |
| D、分子式为C4H8Br2的有机物,结构中只含一个甲基的同分异构体(不考虑立体异构)有5种 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 甲 | 乙 | |
| 丙 | 丁 | 戊 |
| A、原子半径:甲<乙 |
| B、非金属性:乙<丁 |
| C、最高价氧化物的水化物的酸性:丙<丁 |
| D、最外层电子数:丙>丁>戊 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| C |
| H2O |
| HCN |
| 3 |
| 2 |
| 催化剂 |
| 425℃~510℃ |
| A、①②③ | B、①③④ |
| C、②③④ | D、①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、中和10mL 0.1mol?L-1醋酸与中和100mL 0.01mol?L-1的醋酸所需同种碱溶液的量不同 |
| B、常温下,等体积的pH=3的酸溶液和pH=11的碱溶液混合,混合后溶液的pH=7 |
| C、常温下,体积相等、pH相同的盐酸和硫酸溶液,两溶液溶质的物质的量浓度相等 |
| D、常温下,pH=3的甲酸溶液的c(H+)与pH=11的氨水溶液的c(OH-)相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、v(A)=0.5 mol?L-1?s-1 |
| B、v(B)=0.3 mol?L-1?s-1 |
| C、v(C)=0.7 mol?L-1?s-1 |
| D、v(D)=1 mol?L-1?s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 恒容条件下,已知该图中温度T1>T2,则纵轴可表示正反应速率 |
B、 恒温下,已知该图中压强p1>p2,则纵轴可表示NH3的体积分数 |
C、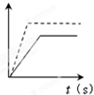 恒温、恒容下,该图中虚线表示开始充入2mol N2和3mol H2,实线表示开始充入1mol N2和3mol H2,则纵轴可表示H2的转化率 |
D、 该图可表示平衡后,t1时在恒温恒压下充入He气时正、逆反应速率的变化曲线 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、X、Y形成化合物表示为X2Y |
| B、X、Y形成的化合物中所含离子都是10电子微粒 |
| C、Y位于周期表中第ⅦA族,其最高正化合价为+7 |
| D、X原子半径小于Y的原子半径 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com