
| 2.72g |
| 17g/mol |
| 6.42g |
| 53.5g/mol |
| 2.72g |
| 17g/mol |
| 6.42g |
| 53.5g/mol |
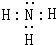 ,
,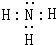 ;
;

 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、H2O、HCOOH、OF2均含有氧元素,都是氧化物 |
| B、HCOOH、H2CO3、H2SO4分子中均含有两个氢原子,都是二元酸 |
| C、HCl、NH3、NaOH溶于水所得溶液都能导电,都是电解质 |
| D、HClO、H2SO4(浓)、HNO3均具有氧化性,都是氧化性酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、生铁的含碳量比钢低 |
| B、油脂的硬化属于化学变化 |
| C、普通玻璃在加热熔化时有固定的熔点 |
| D、向蛋白质溶液中滴加饱和硫酸钠溶液后,蛋白质会发生变性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 有A、B、C、D、E五种短周期元素,已知相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示.E的单质可与酸反应,1mol E单质与足量酸作用,在标准状况下能产生33.6L H2;E的阳离子与A的阴离子核外电子层结构完全相同.
有A、B、C、D、E五种短周期元素,已知相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示.E的单质可与酸反应,1mol E单质与足量酸作用,在标准状况下能产生33.6L H2;E的阳离子与A的阴离子核外电子层结构完全相同.查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 某化学实验中需要用到480mL物质的量浓度为0.5mol?L-1的氯化钾溶液.请回答下列问题:
某化学实验中需要用到480mL物质的量浓度为0.5mol?L-1的氯化钾溶液.请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com