
| A. | 0.05mol/L 的 H2SO4溶液 PH=1 | |
| B. | 0.001mol/L 的 NaOH溶液 PH=11 | |
| C. | 0.005mol/L的H2SO4溶液与0.0lmol/LNaOH溶液等体积浪合,混合液pH=6,溶液呈酸性 | |
| D. | 完全中和PH=3的H2SO4溶液50mL,需要pH=11的NaOH溶液50mL |
分析 100℃的温度下,水的离子积KW=1×10-12,所以该温度下的中性溶液中pH=6,pH小于6的为酸性溶液,大于6的为碱性溶液,pH=-lgc(H+),强酸和强碱反应的混合溶液呈中性时,氢离子和氢氧根离子的物质的量相等,注意碱性溶液中氢氧根离子浓度的计算方法.
解答 解:100℃的温度下,水的离子积KW=1×10-12,所以该温度下的中性溶液中pH=6,
A.0.05 mol•L-1的硫酸溶液中,C(H+)=0.05 mol•L-1×2=0.1mol/L,所以pH=1,故A正确;
B.0.001mol/L的氢氧化钠溶液,C(H+)=10-9 mol/L,pH=9,故B错误;
C.0.005 mol•L-1的硫酸与0.01 mol•L-1的氢氧化钠溶液等体积时,n(H+)=n(OH-),所以硫酸和氢氧化钠恰好反应,溶液呈中性,pH为6,故C错误;
D.pH=3的硫酸中,C(H+)=10-3 mol/L,pH=11的NaOH溶液中C(OH-)=0.1mol/L,中和pH=3的硫酸溶液50 mL,需要pH=11的NaOH溶液0.5mL,故D错误;
故选A.
点评 本题考查pH的简单计算,注意碱性溶液中氢氧根离子浓度和pH的换算,为易错点.


科目:高中化学 来源: 题型:实验题
 如图所示的实验装置,丙为用淀粉碘化钾和酚酞混合溶液润湿的滤纸,m、n为夹在滤纸两端的铂夹.丁为直流电源,x、y为电源的两极.G为电流计,电极均为石墨电极.闭合K2、断开K1,一段时间后,A、B两极产生的气体体积之比为2:1,回答下列问题:
如图所示的实验装置,丙为用淀粉碘化钾和酚酞混合溶液润湿的滤纸,m、n为夹在滤纸两端的铂夹.丁为直流电源,x、y为电源的两极.G为电流计,电极均为石墨电极.闭合K2、断开K1,一段时间后,A、B两极产生的气体体积之比为2:1,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
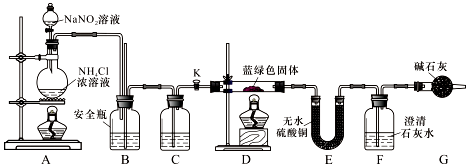
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X被氧化,Y 是氧化剂 | B. | Y被还原,X是氧化剂 | ||
| C. | X是还原剂,Y被氧化 | D. | Y被还原,X2+是还原产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 25℃时,NaHCO3在水中的溶解度比Na2CO3的大 | |
| B. | 图中所示转化反应都是氧化还原反应 | |
| C. | 常温下干燥的Cl2能用钢瓶贮存,所以Cl2不与铁反应 | |
| D. | H2与Cl2反应时产生苍白色火焰并形成白雾 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准况状下,44.8 L四氯筑化碳含有的分子数为2NA | |
| B. | 0.1mol/L氯化铝溶液中含有Al3+数为0.1 NA | |
| C. | 1.8 g重水(D2O)中含有的质子数和电子数均为NA | |
| D. | 常温下,O2和O3的混合气体共16g中含有的氧原子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2+为还原剂,NO3-被还原 | |
| B. | 消耗l mol氧化剂,转移电子8 mol | |
| C. | 氧化产物与还原产物的物质的量之比为1:8 | |
| D. | 若把该反应设计为原电池,则负极反应式为 Fe2+-e-=Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com