
通常人们把拆开1 mol某化学键所消耗的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热。
化学键 | Si—O | Si—Cl | H—H | H—Cl | Si—Si | Si—C |
键能/kJ·mol-1 | 460 | 360 | 436 | 431 | 176 | 347 |
工业上高纯硅可通过下列反应制取:SiCl4(g)+2H2(g) Si(s)+4HCl(g),该反应的反应热△H为
Si(s)+4HCl(g),该反应的反应热△H为
A.+236 kJ·mol-1 B.-236 kJ·mol-1
C.+412 kJ·mol-1 D.-412 kJ·mol-1
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2015届河南省10月联考化学试卷(解析版) 题型:选择题
安全是顺利进行实验及避免伤害的保障.下列实验操作正确且不是从实验安全角度考虑的是( )

A.操作①:使用稍浸入液面下的倒扣漏斗检验氢气的纯度
B.操作②:使用CCl4萃取溴水中的溴时,振荡后需打开活塞使漏斗内气体放出
C.操作③:吸收氨气或氯化氢气体并防止倒吸
D.操作④:用食指顶住瓶塞,另一只手托住瓶底,把瓶倒立,检查容量瓶是否漏水
查看答案和解析>>
科目:高中化学 来源:2015届河南省高三9月第二次阶段考化学试卷(解析版) 题型:选择题
符合前者条件的溶液中一定可以大量共存的离子组是 ( )
A.既能溶解Al(OH)3,又能溶解H2SiO3的溶液:Na+、Fe2+、SO42-、Cl-
B.能使酚酞溶液变红的溶液:Na+、NO3-、S2-、Br -
C.投入铁片能产生H2的无色溶液:H+、Mg2+、SO42-、NO3-
D.含有大量Fe3+的溶液:Na+、Al3+、NO3-、SCN-
查看答案和解析>>
科目:高中化学 来源:2014-2015学年陕西省高三上学期期中理综化学试卷(A)(解析版) 题型:选择题
设NA为阿伏加德罗常数的值,下列有关叙述正确的是
A.0.1mol NH3溶于足量水中(不考虑氨气挥发),溶液中N原子的数目为0.1NA
B.标准状况下,22.4LNO与CO2的混合气体中含有O原子数为3NA
C.0.1molN2与足量的H2反应,转移的电子数是0.6NA
D.58.5 g的NaCl固体中含有NA个氯化钠分子
查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃省天水市高三上学期第四次检测化学试卷(解析版) 题型:填空题
(10分)蛇纹石可用于生产氢氧化镁,简要工程如下:
Ⅰ.制取粗硫酸镁:用酸液浸泡蛇纹石矿粉,过滤,并在常温常压下结晶,制得粗硫酸镁(其中常含有少量Fe3+、Al3+、Fe2+等杂质离子)
Ⅱ.提纯粗硫酸镁,将粗硫酸镁在酸性条件下溶解,加入适量的0.1mol/LH2O2溶液,再调节溶液pH至7~8,并分离提纯。
Ⅲ.制取氢氧化镁,向步骤II所得溶液中加入过量氨水。
已知:金属离子氢氧化物沉淀所需pH
Fe3+ | Al3+ | Fe2+ | Mg2+ | |
开始沉淀时 | 1.5 | 3.3 | 6.5 | 9.4 |
沉淀完全时 | 3.7 | 5.2 | 9.7 | 12.4 |
请回答:
(1)步骤II中加入适量的0.1mol/LH2O2溶液的目的是 ;可用于调节溶液pH至7~8的最佳试剂是 (填字母序号)
A.MgO B.Na2CO3 C.蒸馏水 D.NaOH .
(2)工业上常以Mg2+的转化率为考查指标,确定步骤III制备氢氧化镁工艺过程的适宜条件。
其中,反应温度与Mg2+转化率的关系如图所示。
①步骤III中制备氢氧化镁反应的离子方程式为 。根据图中所示50℃前温度与Mg2+转化率之间的关系,可判断此反应是 (填“吸热”或“放热”反应)

②图中,温度升高至50℃以上Mg2+转化率下降的可能原因是 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃省天水市高三上学期第四次检测化学试卷(解析版) 题型:选择题
将等物质的量浓度的CuSO4溶液和NaCl溶液等体积混合后,用石墨电极进行电解,电解过程中,溶液pH随时间t变化的曲线如图,则下列说法正确的是

A.整个过程中阳极先产生Cl2,后产生O2
B.阳极产物一定是Cl2,阴极产物一定是Cu
C.BC段表示在阴极上是H+放电产生了H2
D.CD段表示阳极上OH一放电破坏了水的电离平衡,产生了H+
查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃省天水市高三上学期第四次检测化学试卷(解析版) 题型:选择题
实验用含有杂质(FeO、Fe2O3)的废CuO制备胆矾晶体,经历下列过程,
已知Fe3+在pH=5时已完全沉淀,其中分析错误的是

A.利用CuCO3替代CuO也可调节溶液的pH,不影响实验结果
B.步骤②中发生的主要反应为:H2O2+2Fe2++2H+=2Fe3++2H2O
C.洗涤:向装晶体的漏斗中加水至浸没晶体,待自然流下后重复2~3次
D.某实验需要240 mL1mol/L的CuSO4溶液,则配制时需称量CuSO4·5H2O 60g
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省莆田市高三上学期第二次月考化学试卷(解析版) 题型:选择题
下列有关实验装置的说法,不正确的是
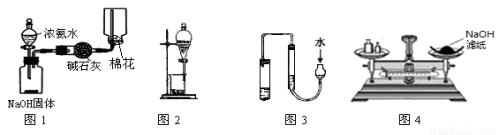
A.用图1装置制取收集干燥纯净的NH3
B.用图2装置可进行碘水中碘的萃取及分液
C.用图3的方法检查此装置的气密性
D.用图4所示称NaOH固体的质量
查看答案和解析>>
科目:高中化学 来源:2014-2015河南省高二上学期第三次月考化学试卷(解析版) 题型:填空题
(9分)下表是不同温度下水的离子积数据:
温度/℃ | 25 | t1 | t2 |
Kw/ mol2·L-2 | 1×10-14 | a | 1×10-12 |
试回答以下几个问题:
(1)若25< t1< t2,则a 1×10-14(填“<”、“>”或“=”),由此判断的理由是:
。
(2)在t1℃下,pH=10的NaOH溶液中,水电离产生的[OH-]为: 。
(3)在t2℃下,将pH=11的苛性钠溶液V1 L与pH=1的硫酸溶液V2 L混合(设混合后溶液体积为原两溶液体积之和)所得溶液的pH=2,则V1︰V2 = ,此溶液中各种离子的浓度由大到小的顺序是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com