

 ,主族元素周期数=电子层数、主族族序数=最外层电子数,故处于第二周期第ⅥA族,
,主族元素周期数=电子层数、主族族序数=最外层电子数,故处于第二周期第ⅥA族, ;第二周期第ⅥA族;
;第二周期第ⅥA族;

科目:高中化学 来源: 题型:
| H2(g) | N2(g) | NH3(g) | |
| 1mol分子中的化学键形成时要释放出的能量/kJ | 436 | 946 | a |
A、如图可表示合成氨过程中的能量变化 |
| B、a的数值为391 |
| C、Q1的数值为92 |
| D、相同条件下,反应物若为2molN2和6molH2,放出热量Q2>2Q1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 短周期元素X、Y、W、Q在元素周期表中的相对位置如图所示.常温下,Al能溶于W的高价氧化物的水化物的稀溶液,却不溶于其浓溶液.下列说法正确的是( )
短周期元素X、Y、W、Q在元素周期表中的相对位置如图所示.常温下,Al能溶于W的高价氧化物的水化物的稀溶液,却不溶于其浓溶液.下列说法正确的是( )| A、元素X、Y的第一电离能:X<Y |
| B、简单离子半径:W>Q>Y>X |
| C、元素X的简单氢化物的空间构型为三角锥形 |
| D、元素W、Q的电负性:W>Q |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、X、Y、W的原子半径依次减小,对应的离子半径依次增大 |
| B、Z的氧化物与水反应可制得相应的含氧酸 |
| C、X、Y、W的最高价氧化物对应水化物之间互相都能发生反应 |
| D、Y的氧化物是两性氧化物,也是活泼金属氧化物,可以和水反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1:1011 |
| B、1:103 |
| C、1:108 |
| D、108:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
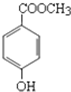 尼泊金酯是一种高效食品防腐剂,其结构简式为:
尼泊金酯是一种高效食品防腐剂,其结构简式为:查看答案和解析>>
科目:高中化学 来源: 题型:
| NaOH溶液 | 银氨溶液 | 新Cu(OH)2 | 金属钠 | |
| A | 中和反应 | -- | 溶解 | 产生氢气 |
| B | -- | 有银镜 | 加热后有红色沉淀 | 产生氢气 |
| C | 水解反应 | 有银镜 | 加热后有红色沉淀 | -- |
| D | 水解反应 | -- | -- | -- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 化学反应的快慢和限度对人类生产生活有重要的意义.
化学反应的快慢和限度对人类生产生活有重要的意义.| 实例 | 影响条件 |
| ①食物放在冰箱里能延长保质期 | 温度(示例) |
| ②实验室将块状药品研细,再进行反应 | |
| ③用H2O2分解制O2时,加入MnO2 | |
| ④工业制硫酸催化氧化SO2制取SO3时,通入过量的空气 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com