
��ѧ��Ӧ�Ħ�H���ڷ�Ӧ�ж��Ѿɻ�ѧ���ļ���֮���뷴Ӧ���γ��»�ѧ���ļ���֮�͵IJ������һЩ��ѧ���ļ��ܣ����ݼ������ݹ��㷴ӦCH4(g)+4F2(g)=CF4(g)+4HF(g)�ķ�Ӧ�Ȧ�HΪ��
��ѧ�� | C��H | C��F | H��F | F��F |
����/��kJ��mol��1�� | 414 | 489 | 565 | 155 |
A. +485 kJ��mol��1 B. ��485 kJ��mol��1 C. +1940 kJ��mol��1 D. ��1940 kJ��mol��1
 �ƸԹھ��ο���ϵ�д�
�ƸԹھ��ο���ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ�����ʡ�˲��и�һ��ѧ����ĩ���Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
�����ƶ���ȷ����(����)
A. ������������ȼ������Al2O3������˿��������ȼ������Fe2O3
B. ���ܴ�����ͭ��Һ���û���ͭ������Ҳ�ܴ�����ͭ��Һ���û���ͭ
C. ���ý����Ʊ�����ú���У��ʻ��ý�����Ҳ������ú����
D. ����������ˮ�ȷ�Ӧʱ�ƾ�����ԭ�����ʽ������ʲ��뷴Ӧʱ����������ԭ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ��ɽ��ʡ�߶���ѧ�ڿ�ѧ���Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
�ö��Ե缫���һ��Ũ�ȵ�����ͭ��Һ��ͨ��һ��ʱ��������õ���Һ�м���0.1molCu2(OH)2CO3��ǡ�ûָ������ǰ��Ũ�Ⱥ�pH(������CO2���ܽ�)����������й�ת�Ƶ��ӵ����ʵ���Ϊ( )
A. 0.4mol B. 0.5mol C. 0.6mol D. 0.8mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ�����ʡ�˲��и߶���ѧ����ĩ���Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
��50 m L 0.1mol/L Na2S ��Һ����μ���50 mL 0.1mol/L KHSO4��Һ��������Һ������Ũ�ȹ�ϵ��ȷ����
A. c(SO42-)= c(HS-)= c(K+)>c(OH-)= c(H+)
B. c(Na+)> c(K+)> c(S2-)> c(H+)> c(OH-)
C. c(Na+)= c(S2-)+ c(HS-)+ c(H2S)+ c(SO42-)
D. c(K+)+ c(Na+)+ c(H+)= c(SO42-)+ c(S2-)+ c(HS-)+ c(OH-)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ�����ʡ�˲��и߶���ѧ����ĩ���Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
ij�¶��£���ӦN2O4(g)  2NO2(g)����H>0�����ܱ������дﵽƽ��.����˵������ȷ����
2NO2(g)����H>0�����ܱ������дﵽƽ��.����˵������ȷ����
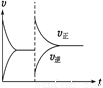
A. ��ѹʱ(�����С)��ƽ�����淴Ӧ�����ƶ�����ʹ����Ӧ��������
B. ijʱ�̸ı���������ʱ������ͼ���ı�������Ǻ���ʱ����N2O4��Ũ��
C. ����������䣬��������N2O4��ƽ��������Ӧ�����ƶ����ٴ�ƽ��ʱ��ɫ����
D. ����ѹǿ���䣬��������N2O4�������������ƽ��������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017������ʡׯ���и�����ѧ����ĩ�������ۻ�ѧ�Ծ��������棩 ���ͣ������
þ���仯�����й㷺��;����ҵ������þ����Ҫ�ɷ�ΪMgCO3����SiO2�Լ�����FeCO3�����ʣ�Ϊԭ���Ʊ���������þ��ʵ����������
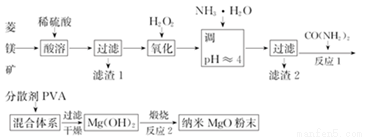
�ش��������⣺
��1������1Ϊ____________���ѧʽ����CO(NH2)2�ĵ���ʽΪ______��
��2����ʵ������������2�ƵõĽ���������Ϊ______���ѧʽ������Ҫ���������ƾ��ơ����ż����⣬����Ҫ______�������ƣ���
��3����һ��������CO(NH2)2����H2O��Ӧ����CO2��һ�������Ӧ�Ļ�ѧ����ʽΪ__________��
��4������ʱ������CO(NH2)2�������������� Mg2+������ȫʱ����Һ�е�c(OH-)=_______������Ũ��С��1.0��10-5 mol•L-1ʱ��������Ϊ�����ӳ�����ȫ������ʱ��Ksp[Mg(OH)2]=1.96��10-11��
��5����ҵ�ϻ������Ȼ�þ��̼���Ϊԭ�ϣ�����ֱ�ӳ�������������MgO����ͼΪ��Ӧ�¶ȶ�����MgO���ʺ�������Ӱ�죬��ͼ������Ӧ������¶�Ϊ__________��
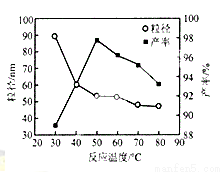
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017������ʡׯ���и�����ѧ����ĩ�������ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
X��Y��Z��W��Ϊ����������Ԫ�أ�ԭ�������������ӣ�Z�ǻ��ý���Ԫ�أ�Y����õ�����Z�ĵ������ʵ������¿ɰ����ʵ���֮��1��4��1��2�ı���ǡ�÷�Ӧ����Q��M��X��W���γ�ǿ�����ᡣ����˵���������
A. �����Ӱ뾶:Z<Y<X<W B. ��̬���⻯����ȶ��ԣ�Y<X
C. Q��M�е����������Ӹ����Ⱦ�Ϊ1��2������ѧ�������в��� D. Z��W���γ�ZW��Z2W�����ӻ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ�����ʡ��ˮ�и߶���ѧ�ڿ�ѧ���ԣ�������ҵ��⣩��ѧ�Ծ��������棩 ���ͣ������
��֪ˮ��25���95��ʱ�������ƽ��������ͼ��ʾ��
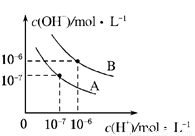
��1��95��ʱˮ�ĵ���ƽ������ӦΪ______���A����B������������______��
��2������A����Ӧ���¶��£�pH=2��HCl��Һ��pH=12��ijBOH��Һ�У���ˮ�ĵ���̶ȷֱ��æ�1����2��ʾ�����1______��2������ڡ�����С�ڡ��������ڡ�����ȷ��������ͬ�����������ߵ������ϣ�������Һ��pH______7��
��3��������B����Ӧ���¶��£���0.02mol•L��1��Ba��OH��2��Һ������ʵ���Ũ�ȵ�NaHSO4��Һ�������ϣ����û��Һ��pH=______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ������ʡׯ���и�һ��ѧ����ĩ���Ի�ѧ�Ծ��������棩 ���ͣ������
���������輰�仯�������������������й㷺����;���Իش��������⣺
��1����������ɫ�����Ϳ�ϵ�������������__________��д��ѧʽ����������������������ϡ�����У����μӼ���KSCN��Һ���ټ�����������ۣ�����ʱ������������_______________��
��2�������ۡ����׳�Ϊ�����ۡ�����������ɫ�������������ۡ����ᣬ������ը��д����Ӧ�Ļ�ѧ����ʽ _____________________�������ۡ����ռ���Һ��Ӧ�����ӷ���ʽΪ______________________��
��3�����ԭ�ӽṹʾ��ͼΪ____________��ˮ����������ľ�ķ����������Ҫ�ɷ��ǣ�д��ѧʽ��________��д����ҵ�����ֹ�Ļ�ѧ����ʽ_______________________�����������£��������衢̼�ۡ����������ʵ���֮��3��6��2��Ӧ�������ɵ������մɣ�һ���������ǽ������ϣ��������¡���ĥ�������������ԣ�����һ�����廯����÷�Ӧ�Ļ�ѧ����ʽΪ______________________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com