
【题目】下列关于反应热的说法正确的是( )
A.已知甲烷的燃烧热为890.3kJ·mol-1,则表示甲烷燃烧热的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-890.3kJ·mol-1
B.将0.5molN2和1.5molH2置于密闭容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g) ΔH=-38.6kJ·mol-1
2NH3(g) ΔH=-38.6kJ·mol-1
C.已知C(石墨,s)=C(金刚石,s) ΔH=+1.9kJ·mol-1,说明金刚石具有的能量比石墨低
D.已知H+(aq)+OH-(aq)=H2O(l) ΔH=-57.4kJ·mol-1,20g氢氧化钠固体溶于稀盐酸中恰好完全反应时放出的热量大于28.7kJ
【答案】D
【解析】
A.燃烧热的定义是一定条件下,1mol纯物质完全燃烧生成稳定的氧化物时放出的热量, 燃烧热中生成液态水,则表示甲烷燃烧热的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-890.3kJ·mol-1,故A错误;
B. 合成氨为可逆反应,且物质的量与热量成正比,将0.5molN2和1.5molH2置于密闭容器中,充分反应生成NH3(g),放热19.3kJ,若1mol N2完全反应放出的热量大于38.6kJ,其热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g) ΔH<-38.6kJ·mol-1,故B错误;
2NH3(g) ΔH<-38.6kJ·mol-1,故B错误;
C. 已知C(石墨,s)=C(金刚石,s) ΔH=+1.9kJ·mol-1,焓变为正值,可知石墨的能量低,根据能量越低越稳定,说明石墨具有的能量比金刚石低,故C错误;
D. 20g氢氧化钠为0.5mol,氢氧化钠固体溶解要放热,同时与盐酸反应放出![]() =28.7 kJ,则完全反应时放出的热量大于28.7kJ,故D正确;
=28.7 kJ,则完全反应时放出的热量大于28.7kJ,故D正确;
答案选D。


 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:
【题目】下列实验装置的相关描述不正确的是
A.![]() 可用于叶绿体中色素的分离
可用于叶绿体中色素的分离
B.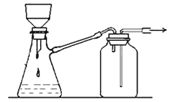 可用于过滤颗粒很小的沉淀,不宜于过滤胶状沉淀
可用于过滤颗粒很小的沉淀,不宜于过滤胶状沉淀
C. 可用于某些化学反应速率的测定。该装置气密性的检查如下:仪器组装好后,关闭分液漏斗活塞,将针筒活塞向外拉一段距离,然后松手,观察针筒是否能回到原来刻度处
可用于某些化学反应速率的测定。该装置气密性的检查如下:仪器组装好后,关闭分液漏斗活塞,将针筒活塞向外拉一段距离,然后松手,观察针筒是否能回到原来刻度处
D. 不可用来模拟氯碱工业
不可用来模拟氯碱工业
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示的是N2 +3H2![]() 2NH3;△H<0达到平衡后,改变条件建立的新平衡(图中横坐标表示反应时间,纵坐标表示反应速率):
2NH3;△H<0达到平衡后,改变条件建立的新平衡(图中横坐标表示反应时间,纵坐标表示反应速率):


(1)表示减少H2的量而建立新平衡的是__________。
(2)表示压缩气体, 体积减小而建立新平衡的是______________。
(3)表示降低温度而建立新平衡的是________。
(4)表示升高温度而建立新平衡的是________。
(5)表示加入催化剂后而建立新平衡的是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸溶液中存在电离平衡 CH3COOH![]() CH3COO- + H+,下列叙述不正确的是
CH3COO- + H+,下列叙述不正确的是
A.升高温度,平衡正向移动,醋酸的电离常数Ka增大
B.CH3COOH溶液加少量的CH3COONa固体,平衡逆向移动
C.室温下,欲使0.1 mol/L醋酸溶液的电离度α增大,可加入少量冰醋酸
D.0.10 mol/L的CH3COOH 溶液加水稀释,溶液中c(CH3COOH)/c(CH3COO-)减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH4和H2O(g)在催化剂表面发生反应CH4(g)+H2O(g) ![]() CO(g)+3H2(g),该反应仅在高温下能自发进行。
CO(g)+3H2(g),该反应仅在高温下能自发进行。
(1)该反应的 ΔH ____0(填“<” “>” 或 “=”)。
(2)T ℃时,向2L密闭容器中投入2mol CH4和1.5mol H2O(g),发生上述反应,平衡时CH4的转化率为50%,该温度下反应的平衡常数K=_____。
(3) T ℃时,向1 L密闭容器中投入2 mol CH4、1 mol H2O(g)、3 mol CO、2 mol H2,则反应的v(正)___v(逆) (选填“<” “>”或“=”)
(4)现向三个体积均为2L的恒容密闭容器I、II、Ⅲ中,均分别充入1molCO 和2mo1H2发生反应:CO(g)+2H2(g)![]() CH3OH(g) ΔH1=-90.1kJ/mol。三个容器的反应温度分别为Tl、T2、T3且恒定不变。当反应均进行到5min时H2的体积分数如图所示,其中只有一个容器中的反应已经达到平衡状态。
CH3OH(g) ΔH1=-90.1kJ/mol。三个容器的反应温度分别为Tl、T2、T3且恒定不变。当反应均进行到5min时H2的体积分数如图所示,其中只有一个容器中的反应已经达到平衡状态。

①5min时三个容器中的反应达到化学平衡状态的是容器_______(填序号)。
②0-5 min内容器I中用CH3OH表示的化学反应速率v(CH3OH)=_______。(保留两位有效数字)
③当三个容器中的反应均达到平衡状态时,CO转化率最高的是容器______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应①:CO(g)+CuO(s) CO2(g)+Cu(s)和反应②:H2(g)+CuO(s) Cu(s)+H2O(g)在相同的某温度下的平衡常数分别为K1和K2该温度下反应③:CO(g)+H2O(g) CO2(g)+H2(g)的平衡常数为K。则下列说法正确的是( )
A.反应①的平衡常数K1=![]()
B.对于反应③,恒容时,温度升高,H2浓度减小,则K变大
C.反应③的平衡常数K=![]()
D.对于反应③,恒温恒容下,增大压强,H2浓度一定减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组利用如图实验装置制备Cu(NH3)xSO4·H2O。并测量x值。
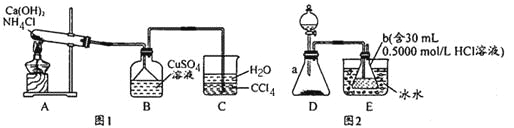
(Cu(NH3)xSO4·H2O制备)见图1
(1)A中发生的化学反应方程式为________________________________。
(2)C中CCl4的作用是______________。
(3)B中先产生蓝色沉淀,随后沉淀溶解变成深蓝色溶液,此溶液中含有Cu(NH3)xSO4,若要从溶液中析出Cu(NH3)xSO4·H2O晶体,可加入试剂___________________________。
(x值的测量)见图2
步骤一:检查装置气密性,称取0.4690g晶体[M=(178+17x)g/mol]于锥形瓶a中
步骤二:通过分液漏斗向锥形瓶a中滴加l0%NaOH溶液至无气体产生为止
步骤三:用0.5000mol/L的NaOH标准溶液液滴定b中剩余HCI,消耗标准溶液液16.00mL
(4)步骤二的反应可理解为Cu(NH3)xSO4与NaOH在溶液中反应,其离子方程式为_________________。
(x值的计算与论证)
(5)计算:x=__________。
该学习小组针对上述实验步骤,提出测量值(x)比理论值偏小的原因如下:
假设1:步骤一中用于称量的天平砝码腐蚀缺损;
假设2:步骤二中_____________________________________________________(任写两点);
假设3 :步骤三中测定结束读数时,体积读数偏小。该假设_______(填“成立”或“不成立”)。
(6)针对假设l,你对实验的处理意见是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在不同温度下按照相同物质的量投料发生反应:CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g) ![]() H<0,测得CO的平衡转化率与压强的关系如图所示,有关说法正确的是 ( )
H<0,测得CO的平衡转化率与压强的关系如图所示,有关说法正确的是 ( )

A.反应温度:T1>T2>T3
B.正反应速率:v 正(d)=v 正(b)
C.混合气体密度:ρ(a)>ρ(b)
D.混合气体平均摩尔质量:M(b)<M(c)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知甲为恒压容器、乙为恒容容器.相同条件下充入等物质的量的![]() 气体,且起始时体积相同.发生反应:2NO2(g)
气体,且起始时体积相同.发生反应:2NO2(g)![]() N2O4(g) △H<0,一段时间后相继达到平衡状态.下列说法中正确的是
N2O4(g) △H<0,一段时间后相继达到平衡状态.下列说法中正确的是

A.平衡时![]() 体积分数:甲
体积分数:甲 ![]() 乙
乙
B.达到平衡所需时间,甲与乙相等
C.该反应的平衡常数表达式K=c2(NO2)/( N2O4)
D.若两容器内气体的压强保持不变,均说明反应已达到平衡状态
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com