
分析 (1)已知:①N2(g)+2O2(g)=N2O4(l)△H1=-19.5kJ?mol-1;②N2H4(l)+O2 (g)=N2(g)+2H2O(g)△H2=-534.2kJ•mol-1根据盖斯定律写出肼和N2O4反应的热化学方程:②×2-①得到:2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g),并以此计算反应热;
(2)①已知:①2NO2(g)+NaCl(s)?NaNO3(s)+ClNO(g),
②2NO(g)+Cl2(g)?2ClNO(g),
根据盖斯定律①×2-②可得:4NO2(g)+2NaCl(s)?2NaNO3(s)+2NO(g)+Cl2(g),则该反应平衡常数为①的平衡常数平方与②的商;
②测得10min内v(ClNO)=7.5×10-3mol•L-1•min-1,则△n(ClNO)=7.5×10-3mol•L-1•min-1×10min×2L=0.15mol,由方程式计算参加反应NO、氯气的物质的量,进而计算平衡时氯气的物质的量、NO的转化率;
正反应为气体物质的量减小的反应,恒温恒容下条件下,到达平衡时压强比起始压强小,其他条件保持不变,反应(Ⅱ)在恒压条件下进行,等效为在恒温恒容下的平衡基础上增大压强,平衡正向移动;
平衡常数只受温度影响,温度不变,平衡常数不变;若要使K2减小,应使平衡逆向移动;
(3)由2NH4++3O2═2HNO2+2H2O+2H+和2HNO2+O2═2HNO3得总方程式为 2NH4++4O2═2HNO3+2H2O+2H+,结合方程式计算.
解答 解:(1)①N2(g)+2O2(g)=N2O4(l)△H1=-19.5kJ?mol-1;②N2H4(l)+O2 (g)=N2(g)+2H2O(g)△H2=-534.2kJ•mol-1
根据盖斯定律写出肼和N2O4反应的热化学方程:②×2-①得到:2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g)△H=-1048.9kJ/mol,
故答案为:2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g)△H=-1048.9kJ/mol;
(2)①2NO2(g)+NaCl(s)?NaNO3(s)+ClNO(g),△H1<0 (Ⅰ),平衡常数K1=$\frac{c(ClNO)}{{c}^{2}(N{O}_{2})}$,
②2NO(g)+Cl2(g)?2ClNO(g),△H2<0 (Ⅱ),平衡常数K2 =$\frac{{c}^{2}(ClNO)}{{c}^{2}(NO)c(C{l}_{2})}$,
①由盖斯定律可知4NO2(g)+2NaCl(s)?2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=$\frac{c(C{l}_{2}){c}^{2}(NO)}{{c}^{4}(N{O}_{2})}$,计算得到K=$\frac{{{K}_{1}}^{2}}{{K}_{2}}$,
故答案为:$\frac{{{K}_{1}}^{2}}{{K}_{2}}$;
②在恒温条件下,向2L恒容密闭容器中加入0.2mol NO和0.1mol Cl2,10min时反应(Ⅱ)达到平衡,测得10min内v(ClNO)=7.5×10-3mol•L-1•min-1,物质的量为7.5×10-3mol•L-1•min-1×10min×2L=0.15mol,
2NO(g)+Cl2(g)?2ClNO(g),
起始量(mol) 0.2 0.1 0
变化量(mol) 0.15 0.075 0.15
平衡量(mol) 0.05 0.025 0.15
则平衡后n(Cl2)=0.025mol,
NO的转化率α1=$\frac{0.15mol}{0.2mol}$×100%=75%;
其他条件保持不变,反应(Ⅱ)在恒压条件下进行,随反应进行,气体体积减小,为保持恒压所以容器体积减小,压强增大,平衡正向进行,平衡时NO的转化率α2 增大;平衡常数随温度变化,不随浓度、压强变化,若要使K2减小,平衡逆向进行,反应是放热反应,依据平衡移动原理应升高温度,平衡逆向进行;
故答案为:0.025;75%;>;不变;升高温度;
(3))①由2NH4++3O2═2HNO2+2H2O+2H+和2HNO2+O2═2HNO3得
2NH4++4O2═2HNO3+2H2O+2H+
36 128
1g 4.57g
故氨态氮元素1g转化为硝酸态氮(硝酸态氮以HNO3表示)时需氧气的质量为4.57g,
故答案为:4.57.
点评 本题综合考查了化学反应与能量变化以及化学平衡的计算,为高频考点,侧重考查学生的分析能力和计算能力,题目难度不大,注意把握平衡常数的计算以及盖斯定律的应用.


科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 已知:pKa=-lgKa,25℃时,H2SeO3的 pKa1=1.34,pKa2=7.34.用0.1mol•L-1NaOH溶液滴定20mL0.1mol•L-1H2SeO3溶液的滴定曲线如图所示(曲线上的数字为pH).下列说法不正确的是( )
已知:pKa=-lgKa,25℃时,H2SeO3的 pKa1=1.34,pKa2=7.34.用0.1mol•L-1NaOH溶液滴定20mL0.1mol•L-1H2SeO3溶液的滴定曲线如图所示(曲线上的数字为pH).下列说法不正确的是( )| A. | a点所得溶液中:2c(H2SeO3)+c(SeO32-)<0.1 mol•L-1 | |
| B. | b点所得溶液中:c(H2SeO3)+c(H+)=c(SeO32-)+c(OH-) | |
| C. | c点所得溶液中:c(Na+)<3c(HSeO3-) | |
| D. | d点所得溶液中:c(Na+)>c(SeO32-)>c(HSeO3-) |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
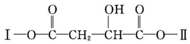 (其中Ⅰ、Ⅱ为未知部分的结构).
(其中Ⅰ、Ⅱ为未知部分的结构).
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学式 | 电离平衡常数 |
| HCN | K=4.9×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.4×10-7,K2=4.7×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| 序号 | 步骤 | 现象 |
| I | 向图2装置内充SO2气体 | G中:有气泡冒出,产生白色沉淀;H中:有气泡冒出,产生白色沉淀;液面上方先略显红棕色,后逐渐消失 |
| Ⅱ | 从G、H中过滤出白色沉淀,分别加入稀盐酸中 | G、H中的白色沉淀均不溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅤⅡA | 0 |
| 1 | ① | |||||||
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | ||
 ,该化合物酸性条件下与高锰酸钾反应的离子方程式:2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2↑
,该化合物酸性条件下与高锰酸钾反应的离子方程式:2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com