
| A�� | 32 g 18O2�к��е���ԭ������2��6.02��1023 | |
| B�� | 1 mol N2��CO�Ļ�������к��еķ���������2��6.02��1023 | |
| C�� | 2.3 g Na��O2��ȫ��Ӧ����3.6 g����ʱʧ��������0.1��6.02��1023 | |
| D�� | 1.0 L 0.1 mol•L-1 NH4NO3��Һ�к��е�笠���������0.1��6.02��1023 |
���� A��18O2��Ħ������Ϊ36g/mol��
B��������N=nNA��
C������Ƶ����ʵ�����Ȼ������ƺ�������Ӧ���Ϊ+1����������
D��笠�����Ϊ���������ӣ�����Һ�л�ˮ�⣮
��� �⣺A��18O2��Ħ������Ϊ36g/mol����32g���������ʵ���С��1mol�����е���ԭ����С��2NA������A����
B��������N=nNA=1mol��NA/mol=NA����B����
C��2.3g�Ƶ����ʵ���Ϊ0.1mol�����ƺ�������Ӧ���Ϊ+1�ۣ���0.1mol��ʧȥ0.1NA�����ӣ���C��ȷ��
D��笠�����Ϊ���������ӣ�����Һ�л�ˮ�⣬����Һ��笠����ӵĸ���С��0.1NA������D����
��ѡC��
���� ���⿼���˰���٤���������йؼ��㣬�������չ�ʽ��ʹ�ú����ʵĽṹ�ǽ���ؼ����ѶȲ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
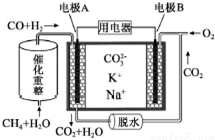
| A�� | �缫A��H2����ĵ缫��ӦΪ��CO+H2+2CO32--4e-=3CO2+H2O | |
| B�� | �����ϣ�A��ÿ����1molH2��������$\frac{1}{3}$molCH4 | |
| C�� | ��ع���ʱ��CO32-��缫A�ƶ� | |
| D�� | �缫B�Ϸ����ĵ缫��ӦΪ��O2+2CO2+4e-=2CO32- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
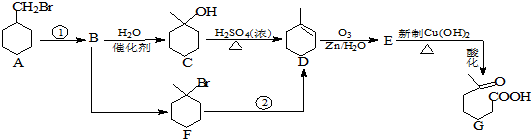
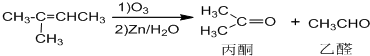
 +NaOH+2Cu��OH��2$\stackrel{����}{��}$
+NaOH+2Cu��OH��2$\stackrel{����}{��}$ +Cu2O��+3H2O��
+Cu2O��+3H2O��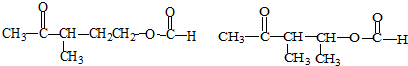
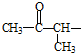 ���������� ���ܷ���������Ӧ
���������� ���ܷ���������Ӧ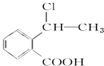 Ϊԭ���Ʊ�
Ϊԭ���Ʊ�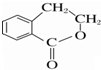 �ĺϳ�·������ͼ�����Լ����ã�����ע����Ӧ������
�ĺϳ�·������ͼ�����Լ����ã�����ע����Ӧ�������鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ����ƽ�ⳣ������Ka��ʾ���Ĵ�С�����жϵ���ʵ����ǿ����25��ʱ���й����ʵĵ���ƽ�ⳣ�����±���ʾ��
����ƽ�ⳣ������Ka��ʾ���Ĵ�С�����жϵ���ʵ����ǿ����25��ʱ���й����ʵĵ���ƽ�ⳣ�����±���ʾ��| ��ѧʽ | HF | H2CO3 | HClO |
| ����ƽ�ⳣ����Ka�� | ��7.2��10-4 | K1=4.4��10-7 K2=4.7��10-11 | ��3.0��10-8 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 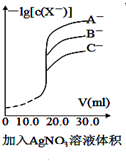 ����������Һ�ζ���Ũ�ȵ�A-��B-��C-�Ļ����Һ����������Ag+��Ӧ���ɳ���������ͼ��ȷ�����ȳ�������C- | |
| B�� | 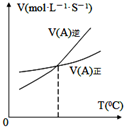 ͼ��ʾ��Ӧ��ij��Ӧ��������淴Ӧ�������¶ȱ仯�������ͼ��֪�÷�Ӧ������Ӧ�����ȷ�Ӧ | |
| C�� | 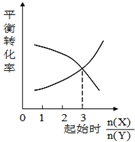 һ�������£�X��Y��Ӧ����Z����ͼ1�Ƴ��÷�Ӧ�ķ���ʽ�ɱ�ʾΪ��X+3Y?Z | |
| D�� | 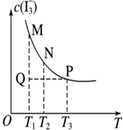 ͼ��ʾ��Һ�з�Ӧ��I2+I-?I3- ƽ��c��I3-�����¶ȱ仯����Ӧ�ٶ�V������M��V���棩N |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
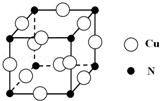 ��͵�Ԫ���ڻ�ѧ���к���Ҫ�ĵ�λ���ش��������⣺
��͵�Ԫ���ڻ�ѧ���к���Ҫ�ĵ�λ���ش��������⣺ ��Ԥ����2017�귢��ġ��϶���š�̽�������õij���5�����ػ��ȼ��Ϊƫ������[��CH3��2NNH2]����CH3��2NNH2��Nԭ�ӵ��ӻ���ʽΪsp3��
��Ԥ����2017�귢��ġ��϶���š�̽�������õij���5�����ػ��ȼ��Ϊƫ������[��CH3��2NNH2]����CH3��2NNH2��Nԭ�ӵ��ӻ���ʽΪsp3��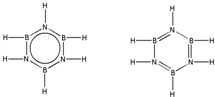 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Cu+4HNO3�TCu��NO3��2+2NO2��+2H2O | B�� | 2NaOH+CuSO4�TNa2SO4+Cu��OH��2�� | ||
| C�� | 2CO+O2�T2CO2 | D�� | 2Al+2NaOH+2H2O�T2NaAlO2+3H2�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
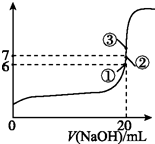
| �ζ����� | ����Һ�����mL�� | ��NaOH��Һ������¼��mL�� | |
| �ζ�ǰ���� | �ζ������ | ||
| ��һ�� | 20.00 | 0.40 | 20.40 |
| �ڶ��� | 20.00 | 4.00 | 24.00 |
| ������ | 20.00 | 2.00 | 24.10 |
| ��ѧʽ | AgCl | AgBr | AgI | Ag2S | Ag2CrO4 |
| ��ɫ | ��ɫ | dz��ɫ | ��ɫ | ��ɫ | ��ɫ |
| Ksp | 2.0��10-10 | 5.4��10-13 | 8.3��10-17 | 2.0��10-48 | 2.0��10-12 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com