
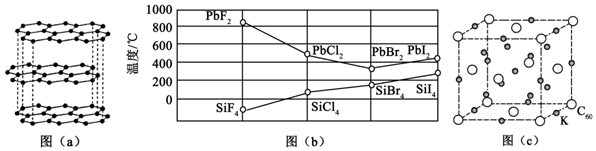
分析 (1)碳的一种单质的结构如图(a)所示,应为石墨,属于混合型晶体,C原子形成3个σ键;
(2)SiCl4分子的中心原子为Si,形成4个σ键,具有甲烷的结构特点;
(3)由图象可知四卤化硅的沸点逐渐升高,为分子晶体,沸点与相对分子质量有关,PbX2的沸点逐渐降低,其中PbF2为离子晶体,PbBr2、PbI2为分子晶体;
(4)K位于棱和体心,C60位于定点和面心,利用均摊法可计算化学式,结合质量、体积计算晶胞的密度大小.
解答 解:(1)碳的一种单质的结构如图(a)所示,应为石墨,属于混合型晶体,在石墨晶体中,同层的每一个碳原子以sp2杂化轨道与相邻的三个碳原子以σ键结合,六个碳原子在同一个平面上形成了正六边形的环,伸展成片层结构,在同一平面的碳原子还各剩下一个p轨道,其中有一个2p电子.这些p轨道又都互相平行,并垂直于碳原子sp2杂化轨道构成的平面,形成了大π键.故答案为:混合晶体;σ键、π键;sp2;
(2)SiCl4分子的中心原子为Si,形成4个σ键,价层电子对数为4,具有正四面体结构,属于非极性分子,故答案为:4;正四面体;非极性;
(3)①四卤化硅的沸点逐渐升高,为分子晶体,沸点与相对分子质量有关,相对分子质量越大,沸点越高,
故答案为:SiX4属于分子晶体,相对分子质量越大,沸点越高;
②PbX2的沸点逐渐降低,其中PbF2为离子晶体,PbBr2、PbI2为分子晶体,可知依F、Cl、Br、I次序,PbX2中的化学键的离子性减弱、共价性增强,
故答案为:减弱;增强;
(4)K位于棱和体心,晶胞中的个数为12×$\frac{1}{4}$+9=12,C60位于定点和面心,个数为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,化学式为K3C60,则晶胞的质量为$\frac{4×837}{{N}_{A}}$g,其晶胞参数为1.4nm=1.4×10-7cm,则体积为(1.4×10-7)3cm3,所以密度为$\frac{\frac{4×837}{{N}_{A}}g}{{(1.4×1{0}^{-7})}^{3}c{m}^{3}}$=2.0g•cm-3,
故答案为:K3C60;2.0.
点评 本题考查较为综合,涉及杂化类型、晶胞的计算以及晶体类型的判断等知识,为高频考点,侧重考查学生的分析能力和计算能力,注意把握石墨的晶体类型以及成键特点,难度中等.


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案科目:高中化学 来源: 题型:选择题
| A. | 可形成YX型化合物 | |
| B. | Y原子质子数比X原子大6 | |
| C. | X、Y的单质在化学反应中均易得到电子 | |
| D. | X、Y的单质均易与氯气反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验 | 除杂试剂 | 实验目的 | |
| ① | CH3CH2Br与NaOH溶液共热 | HNO3溶液 | 用AgNO3溶液检验CH3CH2Br中的Br |
| ② | 淀粉与稀H2SO4水浴共热 | HNO3溶液 | 用银氨溶液检验水解产物的还原性 |
| ③ | C2H5OH与浓 H2SO4加热至170℃ | NaOH溶液 | 用KMnO4溶液证明该反应为消去反应 |
| ④ | 苯与液溴反应 | CCl4 | 用AgNO3溶液证明该反应为取代反应 |
| A. | ①②③④ | B. | 只有③④ | C. | 只有①②④ | D. | 只有①③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O在4000℃以上开始明显分解,H2S用酒精灯加热即可完全分解 | |
| B. | F2在暗处遇H2即爆炸,I2在暗处遇H2几乎不反应 | |
| C. | “NO2球”在冷水中颜色变浅,在热水中颜色加深 | |
| D. | 氯与钠形成离子键,氯与硅形成共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol 乙烯分子中含有的碳氢键数为4NA | |
| B. | 1 mol 甲烷完全燃烧转移的电子数为8NA | |
| C. | 1 L 0.1 mol•L-1的乙酸溶液中含H+的数量为0.1NA | |
| D. | 1 mol 的CO和N2混合气体中含有的质子数为14NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 锂-铜空气燃料电池容量高、成本低,具有广阔的发展前景.该电池通过一种复杂的铜腐蚀“现象”产生电力,其中放电过程为2Li+Cu2O+H2O═2Cu+2Li++2OH-,下列说法不正确的是( )
锂-铜空气燃料电池容量高、成本低,具有广阔的发展前景.该电池通过一种复杂的铜腐蚀“现象”产生电力,其中放电过程为2Li+Cu2O+H2O═2Cu+2Li++2OH-,下列说法不正确的是( )| A. | 放电时,正极的电极反应式为Cu2O+H2O+2e-=2Cu+2OH- | |
| B. | 放电时,电子透过固体电解质向Li极移动 | |
| C. | 通空气时,铜被腐蚀,表面产生Cu2O | |
| D. | 整个反应过程中,氧化剂为O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com