
| 组次 | a | B | c | d | e | f |
| 一 | 16 | | 11 | | | 22 |
| 二 | 16 | | | | | |
| 三 | 16 | | | | | |
| 四 | 16 | | | | | |
| 五 | 16 | | | | | |
| 六 | | | | | | |
| 组次 | a | B | c | d | e | f |
| 一 | 16 | 44 | 11 | 15 | 1 | 22 |
| 二 | 16 | 48 | 12 | 12 | 4 | 24 |
| 三 | 16 | 52 | 13 | 9 | 7 | 26 |
| 四 | 16 | 56 | 14 | 6 | 10 | 28 |
| 五 | 16 | 60 | 15 | 3 | 13 | 30 |
| 六 | 16 | | | | | |


科目:高中化学 来源:不详 题型:单选题
 2MoO3+4SO2 ②MoO3+2NH3·H2O=(NH4)2MoO4+H2O
2MoO3+4SO2 ②MoO3+2NH3·H2O=(NH4)2MoO4+H2O| A.反应①和⑤都属于置换反应 |
| B.MoO3属于碱性氧化物 |
| C.在反应①中Mo和S均被氧化 |
| D.利用H2、CO和铝分别还原等量的MoO3,所消耗还原剂的物质的量之比为2:2:3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
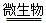 4H++2Fe2++________;
4H++2Fe2++________;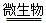 4Fe3++____________;
4Fe3++____________;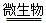 3Fe2++2S;
3Fe2++2S;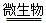 4H++2SO42—。
4H++2SO42—。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.有单质生成的反应一定是氧化还原反应 |
| B.非金属的最高价含氧酸都具有强氧化性 |
| C.两种不同的阴离子在溶液中一定能大量共存 |
| D.同种物质中的同种元素在反应中可能既被氧化又被还原 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.ZnCl2是氧化产物,又是还原产物 |
| B.ZnI2是氧化产物,又是还原产物 |
| C.ICl跟H2O的反应,ICl是氧化剂,H2O是还原剂 |
| D.ICl跟H2O的反应,是自身氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.分解反应一定是氧化还原反应 |
| B.非金属单质在氧化还原反应中一定作氧化剂 |
| C.氧化剂具有氧化性,还原剂具有还原性 |
| D.氧化剂在氧化还原反应中被氧化 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Cu―→CuSO4 | B.C―→CO2 |
| C.Fe(OH)3―→Fe2(SO4)3 | D.Fe2O3―→Fe2(SO4)3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com