
 已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E<F.其中A原子核外有三个未成对电子;化合物B2E的晶体为离子晶体,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的晶体类型在同周期的单质中没有相同的;F原子核外最外层电子数与B相同,其余各层电子均充满.请根据以上信息,回答下列问题:(答题时,A、B、C、D、E、F用所对应的元素符号表示)
已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E<F.其中A原子核外有三个未成对电子;化合物B2E的晶体为离子晶体,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的晶体类型在同周期的单质中没有相同的;F原子核外最外层电子数与B相同,其余各层电子均充满.请根据以上信息,回答下列问题:(答题时,A、B、C、D、E、F用所对应的元素符号表示)分析 A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E<F.C元素是地壳中含量最高的金属元素,则C为Al元素;A原子核外有三个未成对电子,原子序数小于Al元素,其电子排布式为1S22S22P3,则A为N元素;E原子核外的M层中只有两对成对电子,电子排布式为1S22S22P63S23P4,则E为S元素;D单质的晶体类型在同周期的单质中没有相同的,D处于第三周期,故D为Si元素;化合物B2E的晶体为离子晶体,B应为第ⅠA族元素,且原子序数在N元素和Al之间,则B为Na元素;F原子核外最外层电子数与B相同,其余各层均充满,且原子序数最大,电子排布式为1S22S22P63S23P63d104S1,故F为Cu元素,据此解答.
解答 解:A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E<F.C元素是地壳中含量最高的金属元素,则C为Al元素;A原子核外有三个未成对电子,原子序数小于Al元素,其电子排布式为1S22S22P3,则A为N元素;E原子核外的M层中只有两对成对电子,电子排布式为1S22S22P63S23P4,则E为S元素;D单质的晶体类型在同周期的单质中没有相同的,D处于第三周期,故D为Si元素;化合物B2E的晶体为离子晶体,B应为第ⅠA族元素,且原子序数在N元素和Al之间,则B为Na元素;F原子核外最外层电子数与B相同,其余各层均充满,且原子序数最大,电子排布式为1S22S22P63S23P63d104S1,故F为Cu元素.
(1)在元素周期表中,同一周期元素的第一电离能从左到右呈增大趋势,同一主族元素的第一电离能从上到下逐渐减小,据此可判断四种元素的第一电离能的顺序为:Na<Al<Si<N,
故答案:Na<Al<Si<N;
(2)因NaCl为离子晶体,而SiCl4为分子晶体,原子晶体的熔沸点远大于分子晶体的熔沸点,故NaCl晶体熔点高,故答案为:高;NaCl为离子晶体,而SiCl4为分子晶体;
(3)A的最高价酸根离子NO3-,中心N原子价层电子对数为3+$\frac{5+1-2×3}{2}$=3,则N原子采取sp2杂化;
E的最高价氧化物为SO3,S原子孤电子对数为$\frac{6-2×3}{2}$=0,价层电子对数为3+0=3,则为平面三角形结构,
故答案为:sp2;平面三角形;
(4)F为Cu元素,其核外电子排布式为:1s22s22p63s23p63d104s1(或[Ar]3d104s1),铜离子与氨气可以配位键形成配离子,其化学式为[Cu(NH3)4]2+,
故答案为:1s22s22p63s23p63d104s1(或[Ar]3d104s1);[Cu(NH3)4]2+;
(5)A、C形成的化合物为AlN,根据化合物具有高沸点和高硬度,是一种新型无机非金属材料,可判断晶体类型为原子晶体,化学键类型为共价键;
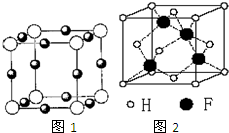
F为Cu,A为N,且N为-3价,由晶胞结构图可知,N原子在顶点,则N原子数为8×$\frac{1}{8}$=1,Cu原子在棱心,则Cu原子数为12×$\frac{1}{4}$=3,所以化学式为Cu3N,
故答案为:AlN;共价键;Cu3N;
(6)Cu+与氢负离子形成的晶体结构如图2所示,该晶体中Cu+的配位数为4,晶胞中Cu+数目为4,H-数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,故晶体化学式为CuH,在氯气中燃烧生成氯化铜与HCl,反应化学方程式为:2CuH+3Cl2$\frac{\underline{\;点燃\;}}{\;}$2CuCl2+2HCl,
故答案为:4;2CuH+3Cl2$\frac{\underline{\;点燃\;}}{\;}$2CuCl2+2HCl;
(7)晶胞质量为4×$\frac{M}{{N}_{A}}$g,晶胞体积为(acm)3,则晶体的密度为:4×$\frac{M}{{N}_{A}}$g÷(acm)3=$\frac{4M}{{a}^{3}{N}_{A}}$g/cm3,
故答案为:$\frac{4M}{{a}^{3}{N}_{A}}$.
点评 本题是对物质结构的考查,涉及元素推断、核外电子排布、电离能、电负性、杂化轨道、分子结构、晶体类型与性质、配合物、晶胞计算等,推断出元素的种类是解答本题的关键,推断时注意从原子的核外电子排布特点以及元素的特殊性质为突破口,需要学生具备扎实的基础,难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2>Fe3+>SO2>I2 | B. | Cl2>Fe3+>I2>SO2 | C. | Cl2>I2>Fe3+>SO2 | D. | Fe3+>I2>Cl2>SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 成分 | 质量(g) | 摩尔质量(g•mol-1) |
| 蔗糖 | 50.00 | 342 |
| 硫酸钾 | 0.50 | 174 |
| 阿司匹林 | 0.35 | 180 |
| 高锰酸钾 | 0.50 | 158 |
| 硝酸银 | 0.04 | 170 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3:2:1 | B. | 1:2:3 | C. | 3:1:1 | D. | 1:3:3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com