
【题目】工业生产中,向Na2CO3溶液中通入SO2气体制备无水Na2SO3,水溶液中H2SO3、HSO3-、SO32-粒子的物质的量分数随pH的分布、Na2SO3的溶解度曲线如图所示:

下列说法不正确的是:
A. 溶液pH=4时,溶质为NaHSO3
B. 溶液pH=10时,c(Na+)+ c(H+)= c(OH–)+ c(SO32–)+ c(HSO3–)
C. 溶液pH=7时, c(SO32–)= c(HSO3–)
D. 溶液pH=10时,停止通入SO2,将溶液加热浓缩至有大量晶体析出,在高于34℃趁热过滤、洗涤、干燥得到无水Na2SO3
【答案】B
【解析】
由水溶液中H2SO3、HSO3-、SO32-粒子的物质的量分数随pH的分布图可知,pH=10时溶质为Na2SO3,pH=4时溶质为NaHSO3;由Na2SO3的溶解度曲线可知,温度高于34℃时,Na2SO3的溶解度随温度升而减小。
A项、由水溶液中H2SO3、HSO3-、SO32-粒子的物质的量分数随pH的分布图可知,溶液pH=4时,溶质为NaHSO3,故A正确;
B项、由水溶液中H2SO3、HSO3-、SO32-粒子的物质的量分数随pH的分布图可知,溶液pH=10时,溶质为Na2SO3,Na2SO3溶液中存在电荷守恒关系c(Na+)+ c(H+)= c(OH–)+ 2c(SO32–)+ c(HSO3–),故B错误;
C项、由水溶液中H2SO3、HSO3-、SO32-粒子的物质的量分数随pH的分布图可知,溶液pH=7时,HSO3-、SO32-粒子的物质的量分数相等,溶液中 c(SO32–)= c(HSO3–),故C正确;
D项、由Na2SO3的溶解度曲线可知,温度高于34℃时,Na2SO3的溶解度随温度升而减小,则将溶液加热浓缩至有大量晶体析出,在高于34℃趁热过滤、洗涤、干燥得到无水Na2SO3,故D正确。
故选B。


 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案科目:高中化学 来源: 题型:
【题目】在体积均为1.0 L的两恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1 mol CO2和0.2 mol CO2,在不同温度下反应 CO2(g)+C(s)![]() 2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是
2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是

A. 反应 CO2(g)+C(s)![]() 2CO(g)的 ΔS>0、ΔH<0
2CO(g)的 ΔS>0、ΔH<0
B. 体系的总压强p总:p总(状态Ⅱ)<2p总(状态Ⅰ)
C. 体系中c(CO):c(CO,状态Ⅱ)<2c(CO,状态Ⅲ)
D. 逆反应速率v逆::v逆(状态Ⅰ)>v逆(状态Ⅲ)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向l0mL0.1mol/L的HR溶液中逐渐滴入0.lmol/L的NH3·H2O 溶液,所得溶液pH及导电性变化如图。下列分析不正确的是

A. ab点导电能力增强,说明HR为弱酸
B. b点溶液,c(NH3H2O)=c(R-)+c(H+)-c(OH-)
C. c点溶液,存在c(NH4+)>c(R-)>c(OH-)>c(H+)
D. 常温下,HR和NH3H2O的电离平衡常数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X,Y,Z,W在周期表中的相对位置如下图所示, 已知它们的最外层电子数之和为18,下列说法正确的是
![]()
A. X,Y,Z,W中可能都是非金属元素
B. Z的最高价氧化物的水化物一定是强酸
C. 元素的最高化合价:W>Z>Y
D. 原子半径由大到小的顺序:W>Z>Y>X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列为四个常用的电化学装置,关于它们的叙述正确的是
A.  正极的电极反应式为MnO2+H2O+e-=MnOOH+OH-
正极的电极反应式为MnO2+H2O+e-=MnOOH+OH-
B.  放电时,外电路中通过2mol电子,理论上正极质量增加96g
放电时,外电路中通过2mol电子,理论上正极质量增加96g
C.  阳极质量的减小值等于阴极质量的增加值
阳极质量的减小值等于阴极质量的增加值
D.  电池的总反应及电极反应均与电解质溶液的酸碱性无关
电池的总反应及电极反应均与电解质溶液的酸碱性无关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】国家实施“青山绿水工程”,大力研究脱硝和脱硫技术。
(1)H2在催化剂作用下可将NO还原为N2。下图是该反应生成1mol水蒸气的能量变化示意图。写出该反应的热化学方程式________________________________。


(2)臭氧也是理想的烟气脱硝剂,其脱硝的反应之一为2NO2(g)+O3(g)![]() N2O5(g)+O2(g),不同温度下,在两个恒容容器中发生上述反应,相关信息如下表及图所示,回答下列问题:
N2O5(g)+O2(g),不同温度下,在两个恒容容器中发生上述反应,相关信息如下表及图所示,回答下列问题:
容器 | 甲 | 乙 |
容积/L | 1 | 1 |
温度/K | T1 | T2 |
起始充入量 | lmolO3 2mol NO2 | lmolO3 2mol NO2 |
①0-10min内甲容器中反应的平均速率:v(O3) =_______mol·L-1·min-1 。
②T1________T2 (填“>”“<”或“=”),T1时,该反应的平衡常数K的值为____________。
③下列措施能提高容器乙中NO2转化率的是________(填序号)。
A.向容器中充入He,增大容器的压强 B.升高容器的温度
C.向容器中再充人一定量的NO2 D.向容器中再充入lmol O3和2mo NO2
④T1时,若起始时向容器甲中充入2mo1 NO2、lmolO3、2mollN2O5和2molO2,则脱硝反应达到平衡前,v(正)________v(逆) (填“>”“<”“=”)。
(3)废水处理时,通H2S(或加S2-)能使某些金属离子生成极难溶的硫化物而除去。25°℃,某废液中c(Mn2+)=0.02mol·L-1,调节废液的pH使Mn2+开始沉淀为MnS时,废液中c(H2S)=0.1mol·L-1,此时pH约为___________。(已知:Ksp(MnS)=5.0×10-14,H2S的电离常数:K1=1.5×10-7,K2=6.0×10-15,1g6=0.8)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A. Na 与 H2O 的反应是熵增的放热反应,该反应能自发进行
B. 饱和 NaCl 溶液加入浓盐酸析出晶体,易溶电解质也存在溶解平衡
C. FeCl3 和 MnO2 均可加快 H2O2 分解,同等条件下二者对 H2O2 分解速率的改变相同
D. Mg(OH)2 固体在溶液中存在平衡:Mg(OH)2(s)Mg2+(aq)+2OH-(aq),该固体可溶于NH4Cl溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,Fe、HCN与K2CO3可发生反应Fe+6HCN+2K2CO3=K4Fe(CN)6+H2↑+2CO2↑+2H2O。请回答下列问题:
(1)金属铁的堆积方式为___________,其配位数为___________。
(2)HCN分子的结构式为___________,写出一种与CN-互为等电子体的阴离子:___________。
(3)键角NH3___________(填“>”“<”或“=")NF3,原因是___________。
(4)K4Fe(CN)6的中心离子的核外电子排布式为___________。
(5)C、N、O、H的第一电离能由小到大的顺序为___________。
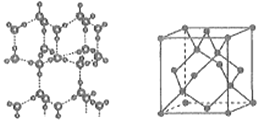
(6)冰的晶体结构模型如图所示,其晶胞结构(如图所示)与金刚石的晶胞结构相似,水分子间以氢键相连,则一个晶胞中含有___________个氢键,用NA表示阿伏加德罗常数的值,若氢键的键长为dnm,则晶体密度ρ=___________g·cm-3(用含有d、NA的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室常用如下装置所示方法制备氯气:
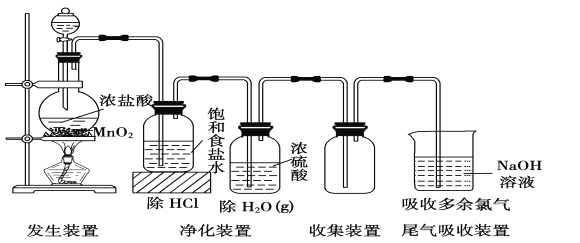
(1)1molMnO2和4mol浓盐酸制得的氯气的产量往往远低于1mol,原因可能是_________________;
(2)若改用NaCl固体、浓硫酸和MnO2一起加热,理论上氯元素利用率可以达到100%,试用化学反应方程式表示原因____________________________________;
(3)若在分液漏斗下方接一段毛细管插入圆底烧瓶底部,不需加热也可获得均匀稳定干燥的氯化氢气流,则分液漏斗和圆底烧瓶中应该盛放的试剂分别是____________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com