
A、B、C、D、E五种短周期元素,它们的原子序数依次增大;A元素的原子半径最小;B元素的最高价氧化物对应水化物与其氢化物能生成盐;D与A同主族,且与E同周期;E元素原子的最外层电子数比次外层电子数少2;A、B、D、E这四种元素,每一种与C元素都能形成原子个数比不相同的若干种化合物。请回答:
(1)C离子的原子结构示意图_______________;D在周期表的位置___________________。
(2)C和E两种元素相比较,原子得电子能力较强的是(填元素名称)________________,以下三种说法中,可以验证该结论的是(填写编号)______________;
a.比较这两种元素的常见单质的沸点
b.二者形成的化合物中,C元素的原子显负价
c.比较这两种元素气态氢化物的稳定性
(3)A、B、C、E可形成两种酸式盐(均含有该四种元素),它们都含有的化学键类型是_________,这两种酸式盐在水溶液中相互反应的离子方程式为_______________________________。
(4)C与D形成的某种化合物可作潜水面具中的供氧剂,每生成标准状况下11.2LO2,转移的电子数是___。
【答案】(1) ; (1分) 第三周期第ⅠA族。(1分)(2)氧(1分) b c (2分)
; (1分) 第三周期第ⅠA族。(1分)(2)氧(1分) b c (2分)
(3)离子键、共价键;(2分) HSO3-+H+=SO2↑+H2O (2分) (4)NA(2分)
【解析】
试题分析:A、B、C、D、E五种短周期元素,它们的原子序数依次增大;A元素的原子半径最小,则A是氢元素;B元素的最高价氧化物对应水化物与其氢化物能生成盐,则B是氮元素;E元素原子的最外层电子数比次外层电子数少2,则E是第三周期硫元素;D与A同主族,且与E同周期,所以D是钠元素;A、B、D、E这四种元素,每一种与C元素都能形成原子个数比不相同的若干种化合物,则C是氧元素,则
(1)氧离子的原子结构示意图为 ;Na在周期表的位置第三周期第ⅠA族。
;Na在周期表的位置第三周期第ⅠA族。
(2)同主族自上而下非金属性逐渐减弱,则C和E两种元素相比较,原子得电子能力较强的是氧元素。a.非金属性强弱与单质的沸点大小无关系,a错误;b.二者形成的化合物中,C元素的原子显负价,说明氧元素得到电子,因此非金属性强于S,b正确;c.氢化物的稳定性越强,非金属性越强,则比较这两种元素气态氢化物的稳定性可以说明,c正确,答案选bc。
(3)A、B、C、E可形成两种酸式盐(均含有该四种元素),分别是亚硫酸氢铵和硫酸氢铵,它们都含有的化学键类型是离子键、共价键;这两种酸式盐在水溶液中相互反应的离子方程式为HSO3-+H+=SO2↑+H2O。
(4)C与D形成的某种化合物可作潜水面具中的供氧剂,该化合物是过氧化钠,标准状况下11.2LO2的物质的量是0.5mol,在该反应中氧元素的化合价从-1价升高到0价,则反应中转移的电子数是0.5mol×2×NA=NA。
考点:考查元素推断以及元素和化合物性质的有关判断


科目:高中化学 来源: 题型:
一定条件下,在一个容积为2 L的密闭容器中加入0.8 mol A2气体和0.6 mol B2气体反应达平衡生成1mol AB气体并释放出热量,反应中各物质的浓度随时间的变化情况如图所示。下列说法不正确的是
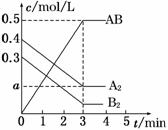
A.图中a点的值为0.15 B.该反应的平衡常数K=0.03
C.温度升高,平衡常数K值减小 D.平衡时A2的转化率为62.5%
查看答案和解析>>
科目:高中化学 来源: 题型:
向l mL 0.5mol·L-1AlCl3溶液中加入3 mL饱和NaF溶液,再加入l mL 3mol·L-1氨水,没有生成白色沉淀,其最主要的原因是
A.3mol·L-1氨水的浓度不够大,溶液的碱性不够强
B.NaF溶液碱性较强,Al3+完全反应生成AlO2-,而AlO2-不能与氨水反应生成Al(OH)3
C.氨水为弱碱溶液,Al3+不与弱碱反应
D.Al3+与F-结合生成新物质,溶液中几乎没有Al3+
查看答案和解析>>
科目:高中化学 来源: 题型:
将下图所示实验装置的K闭合,下列判断正确的是
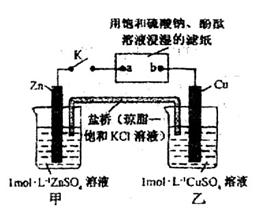
A.Cu电极上发生还原反应
B.电子沿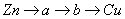 路径流动
路径流动
C.片刻后甲池中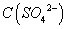 增大
增大
D.片刻后可观察到滤纸b点变红色
查看答案和解析>>
科目:高中化学 来源: 题型:
串联电路中四个电解池分别装有0. 5 mol·L-1的下列溶液,用惰性电极电解,连接直流电源一段时间后,溶液pH最小的是( )
A.KNO3溶液 B.NaCl溶液 C.AgNO3溶液 D.CuCl2溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
有四种燃料电池:A.固体氧化物燃料电池,B.碱性氢氧化物燃料电池,C.质子交换膜燃料电池,D.熔融盐燃料电池,下面是工作原理示意图,其中正极反应生成水的是( )
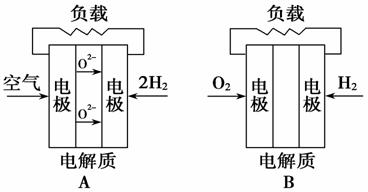
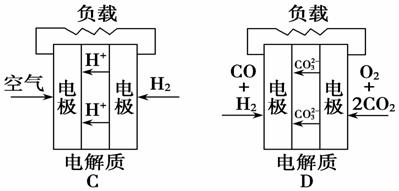
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关阿伏加德罗常数(NA)的说法错误的是( )
A.常温常压下14克CO所含的原子数目为NA个
B.标准状况下0.8molCCl4含有的原子数目为4NA个
C.任何条件下0.5mol氮气分子的分子数一定是0.5NA
D.49克硫酸中含有的原子数目为0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
将由NaOH、BaCl2、Al2(SO4)3三种固体组成的混合物溶于足量的水中,充分溶解,向混合物液中滴加1mol•L-1的稀硫酸,加入稀硫酸的体积与生成沉淀的质量关系如图所示.下列有关判断不正确的是( )
A.AB段发生反应的的离子方程式为:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
B.BC段发生反应的离子方程式为:H++OH-=H2O
C.D点表示的沉淀的化学式为Al(OH)3、BaSO4
D.E点表示的溶液呈中性
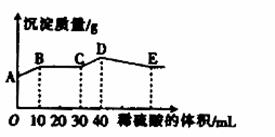
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com