
已知分解1mol H2O2放出热量98KJ。在含有少量I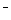 的溶液中,H2O2分解的机理为:
的溶液中,H2O2分解的机理为:
H2O2+ I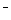
 H2O+IO
H2O+IO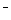
H2O2+ IO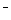
 H2O+O2+ I
H2O+O2+ I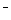
下列有关该反应的说法正确的是( )
A.反应速率与I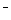 浓度有关 B.IO
浓度有关 B.IO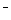 也是该反应的催化剂
也是该反应的催化剂
C.反应活化能等于98KJ mol-1 D.
mol-1 D.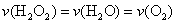
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
聚丙烯酸酯的结构为━[ CH2-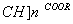 ,下列有关它的说法中,不正确的是
,下列有关它的说法中,不正确的是
A.它可由CH2=CH-COOR经加成聚合反应得到
B.在一定条件下能发生加成反应
C.聚丙烯酸酯材料是一种混合物
D.聚丙烯酸酯是高分子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
MgAgCl电池是一种能被海水激活的一次性贮备电池,电池反应方程式为2AgCl+ Mg === Mg2++ 2Ag +2Cl-。有关该电池的说法正确的是( )
A.Mg为电池的正极
B.负极反应为AgCl+e-===Ag+Cl-
C.不能被KCl 溶液激活
D.可用于海上应急照明供电
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)高铁电池是一种新型可充电电池,与普通电池相比,该电池能较长时间保持稳定的放电电压。高铁电池的总反应为:
3Zn+2K2FeO4+8H2O 3Zn(OH)2+2Fe(OH)3+4KOH。请回答下列问题:
3Zn(OH)2+2Fe(OH)3+4KOH。请回答下列问题:
①高铁电池的负极材料是________。
②放电时,正极发生________(填“氧化”或“还原”)
反应:已知负极反应为Zn-2e-+2OH-===Zn(OH)2,则正极反应为________________________________________________________________。
③放电时,________(填“正”或“负”)极附近溶液的碱性增强。
(2)某种燃料电池的工作原理示意如图所示,a、b均为惰性电极。
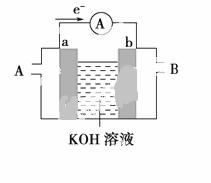
①使用时,空气从________口通入(填“A”或“B”);
②假设使用的“燃料”是甲醇,a极的电极反应式为_______________________________________;
③假设使用的“燃料”是水煤气(成分为CO、H2),如用这种电池电镀铜,待镀金属的质量增加6.4 g,则至少消耗标准状况下水煤气的体积为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在298 K、100 kPa时,已知:
2H2O(g)===2H2(g)+O2(g) ΔH1
Cl2(g)+H2(g)===2HCl(g) ΔH2
2Cl2(g)+2H2O(g)===4HCl(g)+O2(g) ΔH3
则ΔH3与ΔH1和ΔH2间的关系正确的是 ( )。
A.ΔH3=ΔH1+2ΔH2 B.ΔH3=ΔH1+ΔH2
C.ΔH3=ΔH1-2ΔH2 D.ΔH3=ΔH1-ΔH2
查看答案和解析>>
科目:高中化学 来源: 题型:
Na、Cu、O、Si、S、Cl是常见的六种元素。
(1)Na位于元素周期表第 周期第 族;S的基态原子核外有 个未成对电子;Si的基态原子核外电子排布式为 。
(2)用“>”或“<”填空:
| 第一电离能 | 离子半径 | 熔点 | 酸性 |
| Si S | O2- Na+ | NaCl Si | H2SO4 HClO4 |
(3)CuCl(s)与O2反应生成CuCl2(s)和一种黑色固体。在25℃、101KPa下,已知该反应每消耗1 mol CuCl(s),放出44.4KJ,该反应的热化学方程式是 。
(4)ClO2常用于水的净化,工业上可用Cl2氧化NaClO2溶液制取。写出该反应的离子方程式,并标出电子转移的方向和数目 。
查看答案和解析>>
科目:高中化学 来源: 题型:
煤炭燃烧过程中会释放出大量的SO2,严重破坏生态环境。采用一定的脱硫技术可以把硫元素以CaSO4的形式固定,从而降低SO2的排放。但是煤炭燃烧过程中产生的CO又会与CaSO4发生化学反应,降低脱硫效率。相关反应的热化学方程式如下:
CaSO4(s)+CO(g) 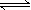 CaO(s) + SO2(g) + CO2(g) ΔH1=218.4kJ·mol-1(反应Ⅰ)
CaO(s) + SO2(g) + CO2(g) ΔH1=218.4kJ·mol-1(反应Ⅰ)
CaSO4(s)+4CO(g) 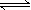 CaS(s) + 4CO2(g) ΔH2= -175.6kJ·mol-1(反应Ⅱ)
CaS(s) + 4CO2(g) ΔH2= -175.6kJ·mol-1(反应Ⅱ)
请回答下列问题:
⑴反应Ⅰ能自发进行的条件是 。
⑵对于气体参与的反应,表示平衡常数Kp时用气体组分(B)的平衡压强p(B)代替该气体物质的量浓度c(B),则反应Ⅱ的Kp= (用表达式表示)。
⑶假设某温度下,反应Ⅰ的速率(v1)大于反应Ⅱ的速率(v2),则下列反应过程能量变化示意图正确的是 。
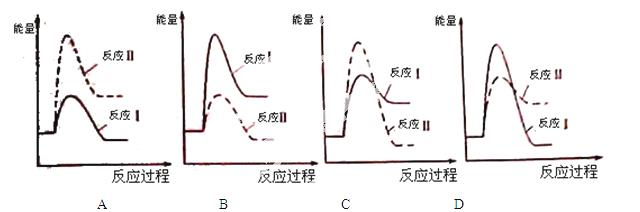
⑷通过监测反应体系中气体浓度的变化可判断反应Ⅰ和Ⅱ是否同时发生,理由是 。
⑸图1为实验测得不同温度下反应体系中CO初始体积百分数与平衡时固体产物中CaS质量百分数的关系曲线。则降低该反应体系中SO2生成量的措施有 。
A.向该反应体系中投入石灰石
B.在合适的温度区间内控制较低的反应温度
C.提高CO的初始体积百分数
D.提高反应体系的温度
⑹恒温恒容条件下,假设反应Ⅰ和Ⅱ同时发生,且v1>v2,则下,请在图2中画出反应体系中c(SO2)随时间t变化的总趋势图。
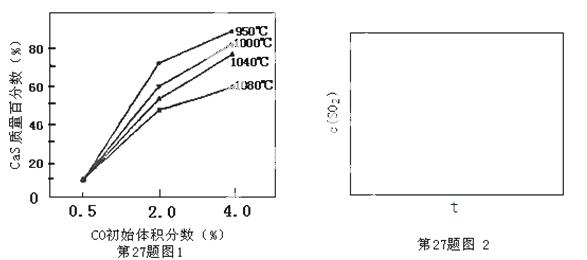
查看答案和解析>>
科目:高中化学 来源: 题型:
如表所示为部分短周期元素的原子半径及主要化合价,根据表中信息判断以下叙述正确的是( )
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.071 | 0.099 |
| 主要化合价 | +2 | +3 | +6、-2 | -1 | -1 |
A.A、B简单离子半径大小关系为B3+>A2+
B.D、E形成的简单离子的还原性:E->D-
C.气态氢化物的稳定性:HD<H2C
D.最高价氧化物对应的水化物的酸性:H2CO4>HEO4
查看答案和解析>>
科目:高中化学 来源: 题型:
G是一种合成橡胶和树脂的重要原料,A是C、H、O三种元素组成的五元环状化合物,相对分子质量为98,其核磁共振氢谱只有一个峰;F的核磁共振氢谱有3个峰,峰面积之比为2:2:3。已知:(其中R是烃基)

有关物质的转化关系如下图所示,请回答以下问题。

(1)A中不含氧的官能团的名称是 ;⑤的反应类型是 。G的结构简式为 ;G与Br2的CCl4溶液反应,产物有 种(不考虑立体异构)。
(2)反应②的化学方程式为 。
(3)E可在一定条件下通过 (填反应类型)生成高分子化合物,写出该高分子化合物可能的结构简式: (两种即可)。
(4)反应⑥的化学方程式为 。
(5)有机物Y与E互为同分异构体,且具有相同的官能团种类和数目,写出所有符合条件的Y的结构简式: 。Y与足量氢氧化钠溶液反应所得产物之一M,能与灼热的氧化铜反应,写出M与灼热的氧化铜反应的化学方程式: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com