
【题目】下面有关丙烷、丙烯、丙炔说法中正确的有( )
A.丙烷、丙烯、丙炔的结构式分别为 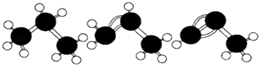
B.相同物质的量的三种物质完全燃烧,生成的气体在标准状态下,体积比3:2:1
C.丙烷、丙烯、丙炔三种物质的熔沸点逐渐升高,相对条件下密度逐渐增大
D.丙烷的碳原子空间结构是锯齿型的,不是简单的线性排列
 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:
【题目】某温度时,在2L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示. 
(1)反应物是 , 生成物是
(2)X的转化率是
(3)由图中所给数据进行分析,该反应的化学方程为
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2通入BaCl2溶液中并不产生沉淀,而通入另一种气体后可以产生白色沉淀.则图中右侧Y形管中放置的药品组合不符合要求的是(必要是可以加热)( ) 
A.Cu和浓硝酸
B.CaO和浓氨水
C.大理石和稀盐酸
D.高锰酸钾溶液和浓盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D,E是前四周期原子序数依次增大的五种元素.A元素原子的核外电子数等于其电子层数,B元素基态原子有三个能级且各能级电子数相同,A与D可形成两种常见液态化合物G、H,其原子数之比分别为1:1和2:1.E元素原子的K、L层电子数之和等于其M、N层电子数之和.请回答下列各题(涉及元素请用相应化学符号表示):
(1)B、C、D三种元素中电负性最大的元素其基态原子的电子排布式为 .
(2)处于一定空间运动状态的电子在原子核外出现的概率密度分布可用形象化描述.在B的基态原子中,核外存在对自旋相反的电子.
(3)由E和D形成的晶胞如图1所示,晶体中E2+周围等距且最近的E2+有个;ED的焰色反应为砖红色,许多金属或它们的化合物都可以发生焰色反应,其原因是 . E和B可形成的晶体的晶胞结构与NaCl晶体的相似(如图2所示),但该晶体中含有的哑铃形B22﹣的存在,使晶胞沿一个方向拉长.晶体中E2+的配位数为 . 该化合物的电子式为 . 
(4)用高能射线照射液态H时,一个H分子能释放出一个电子,同时产生一种阳离子.
①释放出来的电子可以被若干H分子形成的“网”捕获,你认为H分子间能形成“网”的原因是 .
②由H分子释放出电子时产生的一种阳离子具有较强的氧化性,试写出该阳离子与SO2的水溶液反应的离子方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cu及其化合物在科学研究和工业生产中具有许多用途.请回答以下问题:
(1)向CuSO4溶液中滴加氨水至深蓝色透明溶液时,发生的离子反应方程式 .
(2)硫酸铜溶液中滴入氨基乙酸钠(H2N﹣CH2﹣COONa)即可得到配合物A.其结构如图: 
①SO42﹣中S原子的轨道杂化类型是;
②A中碳原子的轨道杂化类型为 .
③1mol氨基乙酸钠含有σ键的数目为 .
(3)元素金(Au)处于周期表中的第六周期,与Cu同族.一种铜合金晶体具有面心立方最密堆积的结构,在晶胞中Cu原子处于面心,Au原子处于顶点位置,该合金中每一层均为(填“密置层”、“非密置层”);该晶体中,原子之间的作用力是;
(4)上述晶体具有储氢功能,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中.若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构与CaF2的晶胞结构相似,该晶体储氢后的化学式应为 . 若Cu原子与Au原子的距离为a cm,则该晶体储氢后的密度为 . (含a的表达式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,甲、乙、丙、丁之间通过一步反应就能实现如图所示变化的是( )
选项 | 甲 | 乙 | 丙 | 丁 |
|
A | S | SO2 | SO3 | H2SO4 | |
B | N2 | NH3 | NO | NO2 | |
C | CuO | Cu | Cu(OH)2 | CuCl2 | |
D | Al | AlCl3 | NaAlO2 | Al2(SO4)3 |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由N、B等元素组成的新型材料有着广泛用途.
(1)B2H6是一种高能燃料,它与Cl2反应生成的BCl3可用于半导体掺杂工艺及高纯硅制造.由第二周期元素组成的与BCl3互为等电子体的阴离子为(填离子符号,填一个).
(2)氨硼烷(H3N→BH3)和Ti(BH4)3均为广受关注的新型化学氢化物储氢材料.
①H3N→BH3中N原子的轨道杂化类型为 .
②Ti(BH4)3由TiCl3和LiBH4反应制得.基态Ti3+的未成对电子数有个,BH4﹣的立体构型是 . 写出该制备反应的化学方程式 .
③氨硼烷可由六元环状化合物(HB=NH)3通过如下反应制得:3CH4+2 (HB=NH)3+6H2O→3CO2+6H3BNH3
与上述化学方程式有关的叙述不正确的是 . (填标号)
A.氨硼烷中存在配位键
B.第一电离能:N>O>C>B
C.反应前后碳原子的轨道杂化类型不变
D.CH4、H2O、CO2分子空间构型分别是:正四面体形、V形、直线形
(3)磷化硼(BP)是受到高度关注的耐磨材料.如图1为磷化硼晶胞. 
①磷化硼晶体属于晶体(填晶体类型),(填是或否)含有配位键.
②晶体中B原子的配位数为 .
(4)立方氮化硼是一种新型的超硬、耐磨、耐高温的结构材料,其结构和硬度都与金刚石相似,但熔点比金刚石低,原因是 .
(5)图2是立方氮化硼晶胞沿z轴的投影图,请在图中圆球上涂“●”和画“×”分别标明B与N的相对位置. 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,取一张用饱和的NaCl溶液浸湿的pH试纸,两根铅笔芯作电极,接通直流电源,一段时间后,发现a电极与试纸接触处出现一个双色同心圆,内圈为白色,外圈呈浅红色.则下列说法错误的是( ) 
A.b电极是阴极
B.a电极与电源的正极相连
C.电解过程中水是氧化剂
D.b电极附近溶液的pH变小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在FeCl3溶液蚀刻铜箔制造电路板的工艺中,废液处理和资源回收的过程简述如下:(己知:Ksp[Fe(OH)3]=4.0×10﹣38) Ⅰ:向废液中投入过量铁屑,充分反应后分离出固体和滤液:
Ⅱ:向滤液中加入一定量石灰水,调节溶液pH,同时鼓入足量的空气.
回答下列问题:
(1)FeCl3蚀刻铜箔反应的离子方程式为:
(2)过程Ⅰ加入铁屑的主要作用是 , 分离得到固体的主要成分是 , 从固体中分离出铜需采用的方法是;
(3)过程Ⅱ中发生反应的化学方程式为;
(4)过程Ⅱ中调节溶液的pH为5,金属离子浓度为 . (列式计算)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com