
 实验室合成乙酸乙酯如(如图所示),得到含有乙醇、乙酸和水的乙酸乙酯粗产品.请回答下列问题:(已知:乙醇、乙酸、乙酸乙酯的沸点依次是(78.5℃、118℃、77.1℃)
实验室合成乙酸乙酯如(如图所示),得到含有乙醇、乙酸和水的乙酸乙酯粗产品.请回答下列问题:(已知:乙醇、乙酸、乙酸乙酯的沸点依次是(78.5℃、118℃、77.1℃)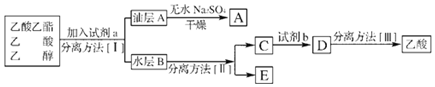
分析 (1)乙酸和乙醇在浓硫酸作用下发生酯化反应,生成乙酸乙酯和水,属于酯化反应;吸收乙酸乙酯的导管不能深入到液面以下,否则容易发生倒吸现象;
(2)乙酸乙酯的制备反应为可逆反应,使用过量乙醇利用反应正向移动;
(3)通过分液漏斗边滴加乙酸边加热蒸馏,分离出乙酸乙酯,平衡正向移动;
(4)由分离流程可知,加试剂a为碳酸钠,分离方法I为分液,油层含乙酸乙酯和水,加无水硫酸钠可吸收水,A为乙酸乙酯;水层含乙醇、乙酸钠、碳酸钠,分离方法II为蒸馏,E为乙醇,C中含乙酸钠、碳酸钠,加试剂b为硫酸,分离方法Ⅲ为蒸馏,以此来解答.
解答 解:(1)乙酸与乙醇在浓硫酸作用下加热发生酯化反应生成乙酸乙酯和水,同时该反应可逆,反应的化学方程式为:CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOC2H5+H2O,挥发出来的乙酸和乙醇易溶于饱和碳酸钠溶液,加热不均匀易造成Na2CO3溶液倒流进加热反应物的试管中,导致试管破裂,所以B中的导管不能插入液面以下的原因是防止倒吸,
故答案为:CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOC2H5+H2O;防倒吸;
(2)反应中加入过量乙醇的目的是提高乙酸的转化率(或提高乙酸乙酯的产率),
故答案为:提高乙酸的转化率(或提高乙酸乙酯的产率);
(3)将上述实验步骤改为在蒸馏烧瓶内先加入乙醇和浓硫酸,然后通过分液漏斗边滴加乙酸边加热蒸馏.这样操作可以提高酯的产率,其原因是及时地蒸出生成物,有利于酯化反应向生成酯的方向进行,
故答案为:及时地蒸出生成物,有利于酯化反应向生成酯的方向进行;
(4)由分离流程可知,加试剂a为碳酸钠,分离方法I为分液,油层含乙酸乙酯和水,加无水硫酸钠可吸收水,A为乙酸乙酯;水层含乙醇、乙酸钠、碳酸钠,分离方法II为蒸馏,E为乙醇,C中含乙酸钠、碳酸钠,加试剂b为硫酸,分离方法Ⅲ为蒸馏,
由上述分析可知a为饱和Na2CO3溶液,I为分液,II为蒸馏,b为硫酸,III为蒸馏,
故答案为:饱和Na2CO3溶液;乙酸乙酯和水;乙醇;分液;蒸馏.
点评 本题考查有机物的制备实验,为高频考点,把握制备原理、混合物分离提纯、实验技能为解答的关键,侧重分析与实验能力的考查,注意有机物的性质,题目难度中等.


 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:解答题
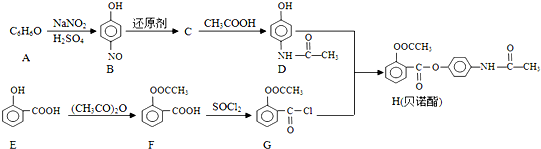
 ;E中含氧官能团的名称为羟基、羧基.
;E中含氧官能团的名称为羟基、羧基. .
.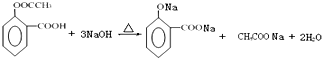 .
.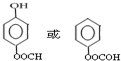 .
.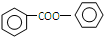 的合成路线流程图(无机试剂可任选):
的合成路线流程图(无机试剂可任选):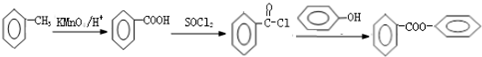 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱式碳酸铜、烧碱均属碱 | |
| B. | CO、SO2均属酸性氧化物 | |
| C. | 凡能电离出H+的化合物均属酸 | |
| D. | 盐类物质一定含有金属离子或铵根离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
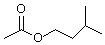 )是组成蜜蜂信息素的成分之一,具有香蕉的香味,实验室制备乙酸异戊酯的反应装置示意图(有关的加热和夹持仪器略去)和有关数据如下:
)是组成蜜蜂信息素的成分之一,具有香蕉的香味,实验室制备乙酸异戊酯的反应装置示意图(有关的加热和夹持仪器略去)和有关数据如下:| 相对分子质量 | 密度/(g•cm-3) | 沸点/℃ | 水中溶解性 | |
| 异戊醇 | 88 | 0.8123 | 131 | 微溶 |
| 乙酸 | 60 | 1.0492 | 118 | 溶 |
| 乙酸异戊酯 | 130 | 0.8670 | 142 | 难溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K不变,平衡可能移动 | B. | 平衡移动,K值一定变化 | ||
| C. | 平衡移动,K值可能不变 | D. | K值变化,平衡一定移动 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年甘肃省高二上10月月考化学试卷(解析版) 题型:选择题
在水中加入下列物质 ,可使水的电离平衡正向移动的是( )
,可使水的电离平衡正向移动的是( )
A.NaOH B.NH4Cl C.NaCl D.H2SO4
查看答案和解析>>
科目:高中化学 来源:2016-2017学年甘肃省高二上10月月考化学试卷(解析版) 题型:选择题
下列溶液肯定呈酸性的是( )
A.含有H+离子的溶液 B.酚酞显无色的溶液
C.C(OH-)<C(H+)的溶液 D.pH小于7的溶液
查看答案和解析>>
科目:高中化学 来源:2017届安徽省黄山市高三上月考二化学卷(解析版) 题型:选择题
下列离子方程式书写正确的是( )
A.NaHSO4溶液与Ba(OH)2溶液反应至中性:H++SO42-+Ba2++OH-=BaSO4↓+H2O
B.足量的溴化亚铁和少量的氯气反应:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-
C.钢铁发生吸氧腐蚀的正极反应式:O2+4e-+2H2O=4OH-
D.用铁作电极电解饱和食盐水:2Cl-+2H2O Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com