
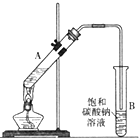
 乙酸乙酯是重要的化工原料.实验室合成乙酸乙酯的装置如图所示.
乙酸乙酯是重要的化工原料.实验室合成乙酸乙酯的装置如图所示.| 乙酸 | 乙醇 | 乙酸乙酯 | 乙醚 | |
| 沸点/℃ | 118 | 78.3 | 77.1 | 34.5 |
| 溶解性 | 易溶于水 | 极易溶于水 | 与乙醚混溶 | 微溶于水 |
分析 (1)为防止酸液飞溅,应先加入乙醇,然后在加入浓硫酸和乙酸;
(2)导管不能插入液面下的原因是防止倒吸;
(3)根据乙酸乙酯不溶于饱和碳酸钠,采用分液的方法分离,再用无水硫酸钠除去乙酸乙酯中的水,最后蒸馏可得纯净的乙酸乙酯;
(4)反应需要浓硫酸作催化剂,产生酸性废水,同时乙醇发生副反应;
(5)白酒中的乙醇和醋中的乙酸发生酯化反应,生成乙酸乙酯和水,使菜肴昧香可口.
解答 解:(1)制取乙酸乙酯时,应先加入乙醇,然后在加入浓硫酸和乙酸,如先加浓硫酸会出现酸液飞溅,
故答案为:乙醇;浓硫酸;乙酸;
(2)导管要插在饱和碳酸钠溶液的液面上,伸入液面下会发生倒吸,
故答案为:防止倒吸;
(3)乙酸乙酯不溶于饱和碳酸钠,采用分液的方法分离,需要分液漏斗,再用无水硫酸钠除去乙酸乙酯中的水,蒸馏时收集77℃左右的液体即得纯净的乙酸乙酯;
故答案为:①分液漏斗;②除去粗产品中的水;③77;
(4)反应需要浓硫酸作催化剂,产生酸性废水,同时乙醇发生副反应;
故答案为:产生酸性废水,污染环境,同时发生副反应;
(5)白酒中的乙醇和醋中的乙酸发生酯化反应,生成乙酸乙酯和水:CH3COOH+HOCH2CH3$\stackrel{△}{→}$CH3COOCH2CH3+H2O;
故答案为:CH3COOH+HOCH2CH3$\stackrel{△}{→}$CH3COOCH2CH3+H2O.
点评 本题考查了酯化反应,掌握混合物的分离和提纯方法,明确实验的实验原理是解答该题的关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
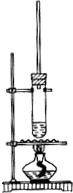 1-丁醇和乙酸在浓硫酸作用下,通过酯化反应制得乙酸丁酯,反应温度为115~125℃,反应装置如右图.下列对该实验的描述错误的是( )
1-丁醇和乙酸在浓硫酸作用下,通过酯化反应制得乙酸丁酯,反应温度为115~125℃,反应装置如右图.下列对该实验的描述错误的是( )| A. | 为了控制温度可以用水浴加热 | |
| B. | 长玻璃管起冷凝回流作用 | |
| C. | 加入过量乙酸可以提高1-丁醇的转化率 | |
| D. | 提纯乙酸丁酯可用饱和碳酸钠溶液洗涤 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 CH3COOC2H5+H2O;
CH3COOC2H5+H2O;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
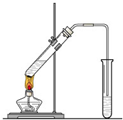 在实验室我们也可以用右图所示的装置制取乙酸乙酯.
在实验室我们也可以用右图所示的装置制取乙酸乙酯.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
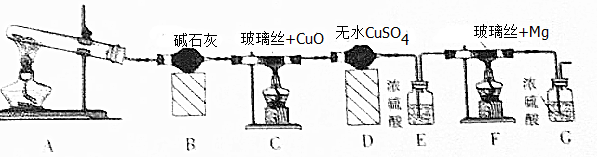
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
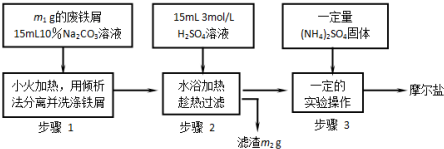
查看答案和解析>>
科目:高中化学 来源:2016-2017学年云南省高一9月月考化学卷(解析版) 题型:选择题
已知:①2FeCl3+2KI===2FeCl2+2KCl+I2;②2FeCl2+Cl2=2FeCl3。下列粒子的氧化性从强到弱的顺序正确的是
A.Cl2 >Fe3+>I2 B.I2>Cl2>Fe3+ C.Fe3+>Cl2>I2 D.Cl2>I2>Fe3+
>Fe3+>I2 B.I2>Cl2>Fe3+ C.Fe3+>Cl2>I2 D.Cl2>I2>Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正、逆反应速率都减小 | B. | 正、逆反应速率都增大 | ||
| C. | 逆反应速率增大,正反应速率减小 | D. | 逆反应速率减小,正反应速率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com