

 H++H2PO4-、H2PO4-
H++H2PO4-、H2PO4-  H++HPO42-、HPO42-
H++HPO42-、HPO42-  H++PO43-
H++PO43-分析 (1)硫原子有16个质子,核外3个电子层,分别容纳2.8.6个电子;
(2)由方程式可知:P4部分磷元素由0价降低到-3价,部分磷元素由0价升高到+5价,磷元素的化合价既升高又降低,Cu元素的化合价由+2价降低到+1价,依据得失电子守恒及原子个数守恒配平方程式;
①Cu3P中铜显+1价,依据代数和为0判断P元素化合价;
②有60mol的CuSO4参加反应,60molCuSO4得到60mol电子,1molP4参加反应失去20mol电子,依据得失电子守恒计算60mol硫酸铜能够氧化白磷的物质的量,然后计算1mol硫酸铜氧化的物质的量;
③磷酸为多元弱酸,是弱电解质,分步电离,用可逆号;
④电离产生的阳离子全都是金属阳离子或者氨根离子,阴离子都是酸根离子的盐属于正盐,磷酸钠为强碱弱酸盐,水解显碱性.
解答 解:(1)硫原子有16个质子,核外3个电子层,分别容纳2.8.6个电子,原子结构示意图为: ;
;
故答案为: ;
;
(2)反应中P4部分磷元素由0价降低到-3价,部分磷元素由0价升高到+5价,磷元素的化合价既升高又降低,Cu元素的化合价由+2价降低到+1价,氧化还原反应氧化剂得到电子总数与还原剂失去电子总数相等,所以P4系数为11,CuSO4系数为96,Cu3P系数为20,H3PO4系数为24,依据原子个数守恒该反应方程式为:
11P4+60CuSO4+96H2O═20Cu3P+24H3PO4+60H2SO4,
①Cu3P中铜显+1价,依据代数和为0,P的化合价为-3价;
故答案为:-3价;
②60mol的CuSO4参加反应,60molCuSO4得到60mol电子,1molP4参加反应失去20mol电子,所以60molCuSO4能氧化白磷的物质的量=$\frac{60}{20}$=3mol,则1molCuSO4能氧化白磷的物质的量,0.05mol;
故答案为:0.05mol;
③磷酸为多元弱酸,分步电离,电离方程式为:H3PO4  H++H2PO4-、H2PO4-
H++H2PO4-、H2PO4-  H++HPO42-、HPO42-
H++HPO42-、HPO42-  H++PO43-;
H++PO43-;
故答案为:H3PO4  H++H2PO4-、H2PO4-
H++H2PO4-、H2PO4-  H++HPO42-、HPO42-
H++HPO42-、HPO42-  H++PO43-;
H++PO43-;
④Na3PO4为强电解质水中完全电离生成钠离子和磷酸根离子,属于正盐;
磷酸钠为强碱弱酸盐,水解显碱性,
故答案:正盐;碱性.
点评 本题为综合题,考查了原子结构示意图书写、氧化还原方程式配平、元素化合价判断、弱电解质的电离、盐类水解规律,题目难度中等,熟悉氧化还原反应规律、熟悉相关概念是解题关键,注意多元弱酸分步电离.


科目:高中化学 来源: 题型:选择题
| A. | c(H+):①>② | |
| B. | 分别加入1L 0.1mol•L-1HCl溶液后,两溶液的pH:①<② | |
| C. | 分别加入等浓度的盐酸至溶液呈中性,消耗盐酸的体积:①<② | |
| D. | n(HF)+n(F-)=n(HClO)+n(ClO-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
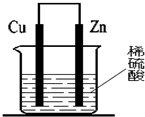
| A. | 电子从大量产生气泡的一极流出 | |
| B. | 反应一段时间后,溶液逐渐变为蓝色 | |
| C. | 逐渐溶解的一极上发生还原反应 | |
| D. | 烧杯内溶液中阳离子的物质的量浓度总和逐渐减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用KSCN溶液检验Fe2+ | B. | 用湿润的红色石蕊试纸检验氨气 | ||
| C. | 用湿润的淀粉碘化钾试纸检验氯气 | D. | 用硝酸酸化的AgNO3溶液检验Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO的燃烧热为566.0 kJ•mol-1 | |
| B. | 2 mol CO和1 mol O2的总能量比2 mol CO2的总能量低 | |
| C. | 完全燃烧20g甲醇,生成二氧化碳和水蒸气时放出的热量为908.3 kJ | |
| D. | 2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-1453.28 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
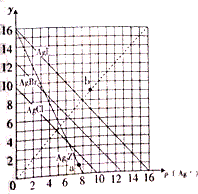 卤化银AgX及Ag2Z的沉淀溶解平衡曲线如图所示,已知横坐标p(Ag+)=-lgc(Ag+),纵坐标y=-lgc(X-)或-lgc(Z2-).下列说法正确的是( )
卤化银AgX及Ag2Z的沉淀溶解平衡曲线如图所示,已知横坐标p(Ag+)=-lgc(Ag+),纵坐标y=-lgc(X-)或-lgc(Z2-).下列说法正确的是( )| A. | 该温度下Ag2Z的Ksp约为1×10-8 | |
| B. | a点可表示AgCl的过饱和溶液 | |
| C. | b点可表示AgI的过饱和溶液,且c(Ag+)=c(I-) | |
| D. | 该温度下AgCl、AgBr形成的混合溶液的饱和溶液中:c(Cl-)<c(Br-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向FeI2溶液中通入等物质的量的Cl2:2I-+Cl2═2Cl-+I2 | |
| B. | 用过量氨水吸收烟道气中的SO2:SO2+NH3•H2O═HSO3-+NH4+ | |
| C. | 向NaHSO4溶液中加入Ba(OH)2至中性:H++SO42-+Ba2++OH-═H2O+BaSO4↓ | |
| D. | 向AgCl饱和溶液中滴加Na2S溶液:2AgCl+S2-═Ag2S+2Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A>B>C>D | B. | A>C>D>B | C. | C>A>B>D | D. | B>D>C>A |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
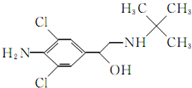 食品安全是现今百姓生活中热议问题之一,瘦肉精学名盐酸克伦特罗,白色或类白色的结晶粉末,无臭、味苦,熔点161℃,溶于水、乙醇,微溶于丙酮,不溶于乙醚.其结构简式如图.有关瘦肉精的说法不正确的是( )
食品安全是现今百姓生活中热议问题之一,瘦肉精学名盐酸克伦特罗,白色或类白色的结晶粉末,无臭、味苦,熔点161℃,溶于水、乙醇,微溶于丙酮,不溶于乙醚.其结构简式如图.有关瘦肉精的说法不正确的是( )| A. | 化学式为C12H18ONCl2 | |
| B. | 遇FeCl3溶液发生显色反应 | |
| C. | 属于芳香族化合物 | |
| D. | 可以发生取代、加成、水解、酯化、消去反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com