
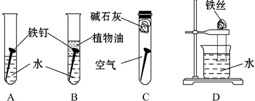
 某研究性学习小组对铁生锈进行研究.
某研究性学习小组对铁生锈进行研究.分析 (1)①铁在潮湿的空气中易发生电化学腐蚀,隔绝空气或在干燥的空气中难以形成原电池反应;
②铁发生电化学腐蚀时,正极上是氧气发生得电子的还原反应;
③将水煮沸可以将水中的空气排出,植物油和水是互不相溶的;
④碱石灰是可以吸水的.
(2)根据金属铁生锈的电化学原理来解释.
解答 解:(1)①铁生锈的外部条件是金属要和空气中的水以及氧气接触,故答案为:和空气以及水接触;
②铁钉发生电化腐蚀,负极上铁为活泼金属,易失去电子而被氧化,正极上是氧气发生得电子的反应O2+2H2O+4e-=4OH-,故答案为:O2+2H2O+4e-=4OH-;
③水中溶解有一定的空气,煮沸可以将空气排出,植物油和水是互不相溶的,它的作用是隔绝空气中的氧气,故答案为:煮沸;隔绝空气中的氧气;
④碱石灰能吸水,它的作用是吸收空气中的水蒸气,故答案为:吸收空气中的水蒸气;
(2)铁生锈会消耗氧气,这样会使试管内压强低于大气压,所以液面上升的原因是铁钉生锈消耗了试管内的氧气,使试管内压强低于大气压,不能证明水对铁钉生锈产生影响,故答案为:铁钉生锈消耗了试管内的氧气,使试管内压强低于大气压;不能.
点评 本题考查金属腐蚀的化学原理,题目难度不大,注意金属发生电化学腐蚀和化学腐蚀的区别,以及形成电化学腐蚀的条件.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 有X、Y、Z、Q、E、M、G原子序数依次递增的七种元素,除G元素外其余均为短周期主族元素.X的原子中没有成对电子,Y元素基态原子中电子占据三种能量不同的原子轨道且每种轨道中的电子数相同,Z元素原子的外围电子排布式为nsnnpn+1,Q的基态原子核外成对电子数是成单电子数的3倍,E与Q同周期,M元素的第一电离能在同周期主族元素中从大到小排第三位,G的阳离子是胆矾晶体中的中心离子.回答下列问题:
有X、Y、Z、Q、E、M、G原子序数依次递增的七种元素,除G元素外其余均为短周期主族元素.X的原子中没有成对电子,Y元素基态原子中电子占据三种能量不同的原子轨道且每种轨道中的电子数相同,Z元素原子的外围电子排布式为nsnnpn+1,Q的基态原子核外成对电子数是成单电子数的3倍,E与Q同周期,M元素的第一电离能在同周期主族元素中从大到小排第三位,G的阳离子是胆矾晶体中的中心离子.回答下列问题: .
. (写在方框内).
(写在方框内).
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
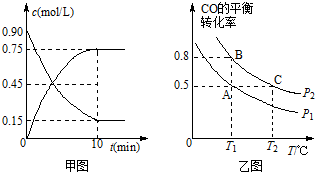
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
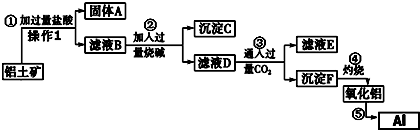
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Z>X>Y | B. | X>Y>Z | C. | Y>X>Z | D. | Y>Z>X |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可用澄清石灰水鉴别Na2CO3和NaHCO3溶液 | |
| B. | 浓硫酸具有吸水性,可做干燥剂,但不能干燥NH3 | |
| C. | 钠保存在煤油中,若长期放置在空气中,最终变为NaHCO3 | |
| D. | 镁着火后可以用CO2来灭火 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
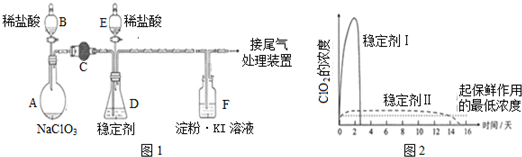
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com