
 CH3OH(g) ¦¤H1
CH3OH(g) ¦¤H1 CH3OH(g) + H2O(g) ¦¤H2
CH3OH(g) + H2O(g) ¦¤H2




| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®Q1< Q2 |
| B£®Éś³ÉĪļ×ÜÄÜĮæ¾łøßÓŚ·“Ó¦Īļ×ÜÄÜĮæ |
| C£®1 mol HBr(g)¾ßÓŠµÄÄÜĮæøßÓŚ1 mol HBr(l)¾ßÓŠµÄÄÜĮæ |
| D£®Éś³É1 mol HClĘųĢåŹ±·Å³öQ1ČČĮæ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®H2(g)µÄČ¼ÉÕČČĪŖ571.6 kJ”¤mol£1 |
| B£®Ķ¬ÖŹĮæµÄH2(g)ŗĶCH3OH(l)ĶźČ«Č¼ÉÕ£¬H2(g)·Å³öµÄČČĮæ¶ą |
| C£®1/2H2SO4(aq)£«1/2Ba(OH)2(aq)===1/2BaSO4(s)£«H2O(l)””¦¤H£½£57.3 kJ”¤mol£1 |
| D£®3H2(g)£«CO2(g)=CH3OH(l)£«H2O(l)””¦¤H£½£«135.9 kJ”¤mol£1 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
 2NH3(g), ”÷H="-92.4" kJ”¤mol”Ŗ1,ŌņH”ŖH¼üµÄ¼üÄÜŹĒ£Ø””””””£©
2NH3(g), ”÷H="-92.4" kJ”¤mol”Ŗ1,ŌņH”ŖH¼üµÄ¼üÄÜŹĒ£Ø””””””£©²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®¢Ł | B£®¢Ś¢Ü | C£®¢Ū¢Ü | D£®¢Ł¢Ś¢Ū |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®2Q2=Q1 | B£®2Q2<Q1 | C£®Q2<Q1<197kJ | D£®Q2=Q1<197kJ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
 ===H2O£Øg£© ”÷H1£½a kJ”¤
===H2O£Øg£© ”÷H1£½a kJ”¤
 ===2H2O£Øg£© ”÷H2£½b kJ”¤
===2H2O£Øg£© ”÷H2£½b kJ”¤
 ===H2O£Øl£© ”÷H3£½c kJ”¤
===H2O£Øl£© ”÷H3£½c kJ”¤
 ===2H2O£Øl£© ”÷H4£½d kJ”¤
===2H2O£Øl£© ”÷H4£½d kJ”¤
| A£®a£¼c £¼0 | B£®b£¾d£¾0 | C£®2a£½b£¼0 | D£®2c£½d£¾0 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
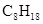 £ØŠĮĶé£©Č¼ÉÕÉś³É¶žŃõ»ÆĢ¼ŗĶŅŗĢ¬Ė®Ź±·Å³ö48.40kJČČĮ森±ķŹ¾ÉĻŹö·“Ó¦µÄČČ»Æѧ·½³ĢŹ½ÕżČ·µÄŹĒ£Ø””£©
£ØŠĮĶé£©Č¼ÉÕÉś³É¶žŃõ»ÆĢ¼ŗĶŅŗĢ¬Ė®Ź±·Å³ö48.40kJČČĮ森±ķŹ¾ÉĻŹö·“Ó¦µÄČČ»Æѧ·½³ĢŹ½ÕżČ·µÄŹĒ£Ø””£©A£®  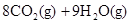 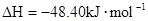 |
B£®  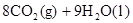 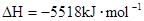 |
C£®  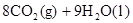 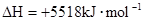 |
D£®  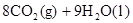 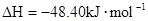 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗĢīæÕĢā
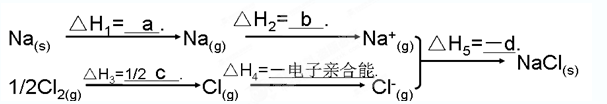
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com