
(8分)近年来燃煤脱硫技术受到各界科研人员的重视,某脱硫技术涉及如下反应:
I CaSO4(s)+ CO(g) CaO(s)+SO2(g)+CO2(g) △H1=+218.4 kJ·mol-l
CaO(s)+SO2(g)+CO2(g) △H1=+218.4 kJ·mol-l
II CaO(s) +3CO(g)+SO2(g) CaS(s)+3CO2(g) △H2=-394.0 kJ·mol-l
CaS(s)+3CO2(g) △H2=-394.0 kJ·mol-l
(1)若用K1、K2分别表示反应I、II的化学平衡常数,则反应1/2CaSO4(s)+2CO(g) 1/2CaS(s)+2CO2(g)的平衡常数K=_________(用含K1、K2的式子表示)
1/2CaS(s)+2CO2(g)的平衡常数K=_________(用含K1、K2的式子表示)
(2)某温度下在一密闭容器中若只发生反应I,测得数据如下:
t/s | 0 | 10 | 20 | 30 | 50 |
c(CO)mol/L | 3 | 1.8 | 1.2 | 0.9 | 0.9 |
前20 s 内v(SO2)=__________mo1·L-l·s-l,平衡时CO的转化率为__________。
(3)某科研小组研究在其它条件不变的情况下,改变起始一氧化碳物质的量,对反应IICaO(s) +3CO(g) +SO2 (g) CaS(s)+3CO2(g)的影响,实验结果如图所示(图中T表示温度):
CaS(s)+3CO2(g)的影响,实验结果如图所示(图中T表示温度):

①比较在a、b、c三点所处的平衡状态中,反应物SO2的转化率最高的是_______________。
②图像中T2_____T1(填“高于”、“低于”、“等于”或 “无法确定”)判断的理由是____________________。
(8分)(1)(K1·K2)1/2 (2分) (2)0.09 70%(每空1分)
(3)① c(1分);②高于(1分)
该反应为放热反应,升高温度平衡向逆反应方向移动,CO2体积分数降低,故T2高于T1(2分)
【解析】
试题分析:(1)K1=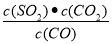 ;K2=
;K2=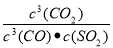 ;K=
;K=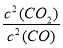 ,K1?K2=
,K1?K2=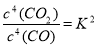 。所以K=(K1·K2)1/2。(2)在反应开始时,c(CO)=3mol/L,在第20s时,c(CO)=1.2mol/L,Δc(CO)=1.8mol/L。根据方程式CaSO4(s)+ CO(g)
。所以K=(K1·K2)1/2。(2)在反应开始时,c(CO)=3mol/L,在第20s时,c(CO)=1.2mol/L,Δc(CO)=1.8mol/L。根据方程式CaSO4(s)+ CO(g) 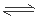 CaO(s)+SO2(g)+CO2(g) 可知产生的c(SO2)=1.8mol/L,v(SO2)=1.8mol/L÷20s=0.09mol/(L?s);物质CO在平衡时的浓度是0.9mol/L,改变浓度是2.1mol/L,所以平衡时CO的转化率为(2.1mol/L÷3mol/L)×100%=70%;(3)①在温度不变时,增大反应物的浓度,可以使其它反应物的浓度增大,而其本身的转化率降低。由于a、b、c三点的温度相同,而c点时CO的起始浓度相同,因此当它们在所处的平衡状态中,反应物SO2的转化率最高的是c点;②由于该反应的正反应是放热反应。升高温度平衡向逆反应方向移动,在图像中,温度在T2时CO2体积分数较低,故温度T2高于T1。
CaO(s)+SO2(g)+CO2(g) 可知产生的c(SO2)=1.8mol/L,v(SO2)=1.8mol/L÷20s=0.09mol/(L?s);物质CO在平衡时的浓度是0.9mol/L,改变浓度是2.1mol/L,所以平衡时CO的转化率为(2.1mol/L÷3mol/L)×100%=70%;(3)①在温度不变时,增大反应物的浓度,可以使其它反应物的浓度增大,而其本身的转化率降低。由于a、b、c三点的温度相同,而c点时CO的起始浓度相同,因此当它们在所处的平衡状态中,反应物SO2的转化率最高的是c点;②由于该反应的正反应是放热反应。升高温度平衡向逆反应方向移动,在图像中,温度在T2时CO2体积分数较低,故温度T2高于T1。
考点:考查化学平衡常数的关系、物质的转化率的计算与比较、反应温度的高低比较的知识。


 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源:2014-2015学年上海市虹口区高三上学期期末考试化学试卷(解析版) 题型:填空题
(本题共12分)对燃煤烟气和汽车尾气进行脱硝、脱碳和脱硫等处理,可实现绿色环保、节能减排等目的。汽车尾气脱硝脱碳的主要原理为:
2NO(g)+2CO(g) N2(g)+2CO2(g) ΔH=
N2(g)+2CO2(g) ΔH=  Q(Q>0)。
Q(Q>0)。
一定条件下,在一密闭容器中,用传感器测得该反应在不同时间的NO和CO浓度如下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)/mol·L-1 | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
c(CO)/mol·L-1 | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
29.写出该反应的平衡常数表达式__________________________________________。
30.前2s内的平均反应速率υ(N2) = mol/(L·s);达到平衡时,CO的转化率为 。
31.下列描述中能说明上述反应已达平衡的是________________
A.2υ正(NO)=υ逆(N2)
B.容器中气体的平均分子量不随时间而变化
C.容器中气体的密度不随时间而变化
D.容器中CO的转化率不再发生变化
32.采用低温臭氧氧化脱硫脱硝技术,同时吸收SO2和NOx,获得(NH4)2SO4的稀溶液。往(NH4)2SO4溶液中再加入少量 (NH4)2SO4固体, 的值将 (填“变大”、“不变”或“变小”)
的值将 (填“变大”、“不变”或“变小”)
33.有物质的量浓度相等的三种铵盐溶液:①NH4Cl ②NH4HCO3 ③NH4HSO4,这三种溶液中水的电离程度由大到小的顺序是________________(填编号);
34.向BaCl2溶液中通入足量SO2气体,没有沉淀生成,继续滴加一定量的氨水后,生成BaSO3沉淀。用电离平衡原理解释上述现象__________________________________________________________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市长宁区高三上学期教学质量检测化学试卷(解析版) 题型:选择题
最近有科学家成功地在高压下将CO2转化具有类似SiO2结构的原子晶体,下列关于CO2的原子晶体说法正确的是
A.在一定条件下,CO2原子晶体转化为分子晶体是物理变化
B.CO2的原子晶体和CO2分子晶体具有相同的物理性质和化学性质
C.在CO2的原子晶体中,每个C原子周围结合4个O原子,每个O原子跟两个C原子相结合
D.CO2的原子晶体和分子晶体组成相同,实际上是同一种物质
查看答案和解析>>
科目:高中化学 来源:2014-2015学年陕西省五校高三第一次模拟联考理综化学试卷(解析版) 题型:填空题
(14分)某兴趣小组同学在实验室用加热1-丁醇、浓H2SO4和溴化钠混合物的方法来制备1-溴丁烷,并检验反应的部分副产物,设计了如图所示装置,其中夹持仪器、加热仪器及冷却水管没有画出。

请根据实验步骤,回答下列问题:
(1)关闭a和b、接通竖直冷凝管的冷凝水,给A加热30分钟,制备1-溴丁烷。
竖直冷凝管接通冷凝水,进水口是_____(填“I”或“Ⅱ”);冷凝回流的主要目的是________。
(2)理论上,上述反应的副产物可能有:丁醚(CH3CH2CH2CH2-O-CH2CH2CH2CH3)、1-丁烯、溴化氢、硫酸氢钠、水等。熄灭酒精灯,在竖直冷凝管上方塞上塞子并打开a,利用余热继续反应直至冷却,通过B、C装置检验部分副产物。
B、C中应盛放的试剂分别是_________和 ,写出C装置中主要的化学方程式:_______________。
(3)为了进一步分离提纯1-溴丁烷,该兴趣小组同学查得相关有机物的数据如表所示:
物质 | 熔点/℃ | 沸点/℃ |
1-丁醇 | -89.5 | 117.3 |
1-溴丁烷 | -112.4 | 101.6 |
丁醚 | -95.3 | 142.4 |
1-丁烯 | -185.3 | -6.5 |
请你补充下列实验步骤,直到分离出1-溴丁烷。
①待烧瓶冷却后,拔去竖直的冷凝管;
②_______;③_______;④_______;⑤_______,收集所得馏分。
(4)若实验中所取1-丁醇、NaBr分别为7.4 g、13.0 g,蒸出的粗产物经洗涤、干燥后再次蒸馏得到9.6 g1-溴丁烷,则1-溴丁烷的产率是_____。(保留2位有效数字)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年陕西省五校高三第一次模拟联考理综化学试卷(解析版) 题型:选择题
2013年7月23日,央视记者分别在北京崇文门附近的麦当劳、肯德基以及真功夫3家大型快餐店取回可食用冰块进行抽样检测。检测结果显示:3家快餐店食用冰块菌落总数严重超标。下列说法正确的是
A.肉毒杆菌有毒,可在其中加入硫酸铜使其变性后食用
B.肉毒杆菌在体内水解生成的氨基酸不能成为人体重要的营养物质
C.大肠杆菌分子中不一定含羧基和氨基
D.出血性大肠杆菌和油脂均为能水解的高分子化合物
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山西省等四校高三第二次联考化学试卷(解析版) 题型:选择题
完成下列实验所选择的装置或仪器(夹持装置部分已略去)正确的是
A | B | C | D | |
实 验 | 分离Na2CO3溶液和CH3CH2OH | 除去Cl2中含有的少量HCl | 做Cl2对NaOH溶液的喷泉实验 | 制取少量氨气 |
装 置 或 仪 器 |
|
|
|
|
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山西省等四校高三第二次联考化学试卷(解析版) 题型:选择题
下列有关溶液组成的描述合理的是
A.在Fe2(SO4)3溶液中可以大量存在: K+、Fe2+、Cl-、Br-、SCN-
B.c(H+)=1×10-13mol/L的溶液中可以大量存在:Mg2+、Cu2+、HCO3-、NO3-
C.加水稀释时c(OH-)/c (H+)值增大的溶液中可大量存在:MnO4-、CO32-、K+、NH4+
D.在碱性溶液中可以大量存在:S2O32- 、AlO2-、SiO32-、S2- 、Na+
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省曲阜市高三上学期期中考试化学试卷(解析版) 题型:填空题
(15分)I(10分)A、B、C、D均为中学化学中常见的物质,它们之间转化关系如下图(部分产物已略去):

试回答:
(1)若D是具有氧化性的单质,则属于主族的金属A为___________(填元素符号)
(2)若D是金属,C溶液在储存时应加人少最D,其理由是(用必要的文字和离子方程式表示)_____________________;
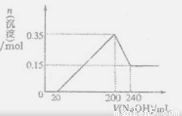
(3)若A、B、C为含同一种金属元素的无机化合物.在溶液中A和C反应生成B。请写出B转化为C的所有可能的离子力程式_________________________________________。化合物B经过一系列反应可以得到单质E,将一定质量的Mg和E的混合物投人500m1稀硫酸中,固体全部溶解并产生气体。待反应完全后.向所得溶液中加人NaOH溶液,生成沉淀的物质的是与加人溶液的体积关系如下图所示。则固体混合物中Mg的质量为_____________;NaOH溶液的物质的量浓度为___________。
II(5分)某一离子反应体系有反应物和产物共以下六种:
已知该反应中的H2O2只发生如下过程: 
(1)该反应中的还原剂是___________。
(2)该反应中发生还原反应的过程是_____→_____。
(3)溶液随着酸性的增强氧化性不断增强,应选择__________(选填“稀硫酸”或“浓盐酸”)进行KMnO4溶液的酸化。
(4)如反应转移了0.6mo1电子,则产生的气体在标准状况下体积为__________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省高三1月检测化学试卷(解析版) 题型:选择题
下列说法或表示方法正确的是
A.等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出热量多
B.由C(石墨)===C(金刚石);ΔH=+1.90kJ·mol-1可知金刚石比石墨稳定
C.在101kPa时,2g H2完全燃烧生成液态水放出285.8kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)==2H2O(l);ΔH=-285.8kJ·mol-1
D.在稀溶液中,H+(aq)+OH-(aq)==H2O(l);ΔH=-57.3kJ·mol-1,若将含0.5mol H2SO4的浓硫酸与含1mol NaOH的溶液混合,放出的热量大于57.3kJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com