
| A. | 接触法制硫酸 | B. | 联合法制纯碱 | ||
| C. | 铁矿石炼铁 | D. | 石油的裂化和裂解 |
分析 A、接触法制硫酸分三步,4FeS2+11O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2; SO2+$\frac{1}{2}$O2═SO3 SO3+H2O═H2SO4,每一步都要发热;
B、联合法制纯碱分二步,主要是先向饱和氯化钠溶液中通氨气、二氧化碳生成碳酸氢钠晶体,过滤得碳酸氢钠在加热分解生成纯碱;
C、铁矿石炼铁主要是一氧化碳还原氧化铁,该反应吸热;
D、石油的裂化裂解是在高温下使含碳个数多的烃分解的过程,需要吸热;
解答 解:A、接触法制硫酸分三步,4FeS2+11O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2; SO2+$\frac{1}{2}$O2═SO3 SO3+H2O═H2SO4,每一步都要发热,所以为了节约能源,可以将接触法制硫酸放出的热量进行再利用,故A正确;
B、联合法制纯碱分二步,主要是先向饱和氯化钠溶液中通氨气、二氧化碳生成碳酸氢钠晶体,过滤得碳酸氢钠在加热分解生成纯碱,主要是需要吸热,所以不涉及到反应热再利用,故B错误;
C、在炼铁过程中,焦炭先跟热空气中的氧气发生反应,生成二氧化碳,二氧化碳再与炽热的焦炭反应,生成一氧化碳,一氧化碳在还原氧化铁,主要是需要吸热,所以不涉及到反应热再利用,故C错误;
D、石油的裂化裂解是在高温下使含碳个数多的烃分解的过程,需要吸热,所以不涉及到反应热再利用,故D错误.
故选:A.
点评 主要考查了工业生成,注意接触法制硫酸每一步都要发热,所以为了节约能源,可以将接触法制硫酸放出的热量进行再利用.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KOH中含有离子键也含有共价键,属于离子化合物 | |
| B. | HCl中存在离子键,属于离子化合物 | |
| C. | 含有共价键的化合物一定是共价化合物 | |
| D. | 阴、阳离子间通过静电引力而形成的化学键叫做离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v1>10v2 | |
| B. | 加少量水稀释,氨水中$\frac{c(N{H}_{4}^{+})}{c(N{H}_{3}•{H}_{2}O)}$都减小 | |
| C. | v2≈v3 | |
| D. | 中和热A=B=C |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑩ | ⑨ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
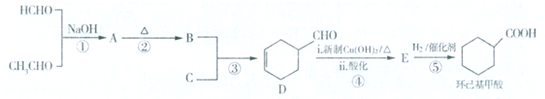
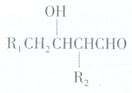 或
或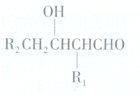
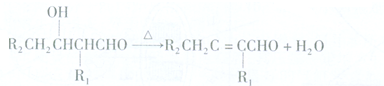
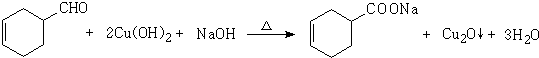 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
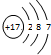 ,关于该粒子的说法不正确的是( )
,关于该粒子的说法不正确的是( )| A. | 核电荷数为17 | B. | 该粒子的化学式为Cl- | ||
| C. | 元素的最低化合价为-1 | D. | 与活泼金属反应时容易得电子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com