
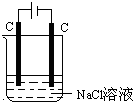
 图为电解饱和食盐水示意图,下列说法正确的是( )
图为电解饱和食盐水示意图,下列说法正确的是( )| A、阳上析出氢气 |
| B、阴极上发生氧化反应 |
| C、电解时,溶液的pH增大 |
| D、与电源正极相连的是电解池的阴极 |
| ||


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 A、B两种酸溶液的pH都是2,各取1mL分别加水稀释成1000mL,其pH的变化如图所示,则下列判断正确的是( )
A、B两种酸溶液的pH都是2,各取1mL分别加水稀释成1000mL,其pH的变化如图所示,则下列判断正确的是( )| A、原酸溶液的浓度c(A)=c(B) |
| B、原酸溶液的浓度c(A)>c(B) |
| C、若a=5,则A为强酸,B为弱酸 |
| D、若2<a<5,则A、B都是弱酸,酸性A<B |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、盛放氢氧化钠溶液的试剂瓶不能用玻璃塞:SiO2+2NaOH═Na2SiO3+H2O | ||||
B、高温下铁与水蒸气反应生成保护膜:2Fe+6H2O(g)
| ||||
| C、工业制取漂粉精:2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O | ||||
| D、实验室制取氨气:2NH4Cl+Ca(OH)2═CaCl2+2NH3↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、无色溶液中:K+、Na+、MnO4-、SO42- |
| B、由水电离出的c(OH- )=1.0×10-13mol L-1的溶液中:Na+、Ba2+、Cl-、Br- |
| C、有较多Fe3+的溶液中:Na+、NH4+、HCO3-、SO42- |
| D、强酸性溶液中:K+、NH4+、I-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下,醋酸钠与醋酸的混合溶液pH=7,C(Na+)>c(CH3COO-) |
| B、0.1mol/L Na2CO3溶液中:c(OH-)=c(HCO3-)+c(H+)+c(H2CO3) |
| C、将pH=6的H2SO4稀释1000倍后,c(H+)=2c(SO42-) |
| D、0.1mol/L NaHCO3溶液中:c(Na+)+c(H+)=c(HCO3-)+c(OH-)+2c(CO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
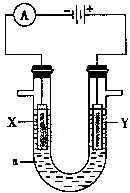 电解原理在化学工业中有广泛的应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.
电解原理在化学工业中有广泛的应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com