
����Ŀ��̽������������������������ڲ�ͬ��ʵ�������½��з�Ӧ������ڲ�ͬʱ��(t)�ڲ����������(V)��������ͼ��ʾ������ͼʾ����ʵ������������˵���в���ȷ����
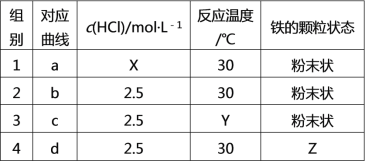
A. ��1��2��ʵ���Ŀ����̽��Ũ�ȶԷ�Ӧ����Ӱ��X > 2.5
B. ��2��3��ʵ���Ŀ����̽���¶ȶԷ�Ӧ����Ӱ��Y < 30
C. ��2��4��ʵ���Ŀ����̽�����Ŀ���״̬�Է�Ӧ����Ӱ��ZΪƬ״
D. ��3��ʵ��һ�����˴���
���𰸡�D
��������
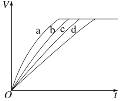
��ͬʱ�����������������Խ��˵����Ӧ����Խ�죬��ͼ��֪����Ӧ����a��b��c��d��
�������������Ũ�ȡ��¶ȡ�ѹǿ�������������������Ի�ѧ��Ӧ���ʵ�Ӱ����з�����
�¶�Խ�ߡ���������Խ��Ӧ���Ũ��Խ��ѧ��Ӧ����Խ�죬�ݴ˽��
��ͬʱ�����������������Խ��˵����Ӧ����Խ�죬��ͼ��֪����Ӧ����a��b��c��d��
A����1��2��ʵ��Ƚϣ���1��ʵ�鷴Ӧ����ʱ��̣��ʷ�Ӧ���ʿ죬���ݿ��Ʊ�������ԭ��֪��1��ʵ�������Ũ��Ӧ����2.5molL-1����X > 2.5����A��ȷ��
B����2��3��ʵ�飬��2�鷴Ӧ���ʱȵ�3��죬2��3����ȣ�Ũ�ȡ�����������ͬ���¶�Խ�߷�Ӧ����Խ�죬�ʵ�3��ʵ��ķ�Ӧ�¶ȵ���30�棬��Y < 30����B��ȷ��
C����2��4��ʵ�飬��2��ʵ�飬���Ƿ�ĩ״�����ݿ��Ʊ�����ԭ��֪��4��ʵ����ΪƬ״����ZΪƬ״����C��ȷ��
D�������ܼӿ췴Ӧ���ʣ�����ͼ֪����Ӧ����a��b��c��d�����Ե�3��ʵ�鲻һ���Ǽ��˴�������D����
��ѡD��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(l)![]() ��H2O(g) ��H1��a kJ��
��H2O(g) ��H1��a kJ��![]()
(2)![]() ��2H2O(g) ��H2��b kJ��
��2H2O(g) ��H2��b kJ��![]()
(3)![]() ��H2O(l) ��H3��c kJ��
��H2O(l) ��H3��c kJ��![]()
(4)![]() ��2H2O(l) ��H4��d kJ��
��2H2O(l) ��H4��d kJ��![]()
���й�ϵʽ����ȷ����( )
A. a��c��0 B. b��d��0 C. 2a��b��0 D. 2c��d��0
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��t��ʱ����2mol����A��1mol����B�����ݻ�Ϊ2L�ĺ����ܱ������У��������·�Ӧ��2A(g)+B(g)![]() xC(g)��2minʱ��ѧ��Ӧ�ﵽ��(�¶���Ϊt��)����ʱB���� 0.6mol�������C��Ũ��Ϊ0.6mol/L����ش��������⣺
xC(g)��2minʱ��ѧ��Ӧ�ﵽ��(�¶���Ϊt��)����ʱB���� 0.6mol�������C��Ũ��Ϊ0.6mol/L����ش��������⣺
(1)�жϸ÷�Ӧ�ﵽ�ȵı�־��_____________ ��
a�������е�ѹǿ���ֲ���
b��A������������B����������֮��Ϊ2��1
c�������ڻ��������ܶȱ��ֲ���
d��A�İٷֺ������ֲ���
e��B��C�����ʵ���Ũ��֮��Ϊ1��x
(2)x=_______�� �ӷ�Ӧ��ʼ���ﵽ��ʱ����B��ʾ�÷�Ӧ��ƽ����Ӧ����V(B)=_________��
(3)�������¶Ȳ��䣬�������������������Ӧ����___(����������������С������������)
(4)��ѧ��Ӧ�ﵽ��ʱ��A��ת����Ϊ__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʱ����H2CO3��Һ����μ���NaOH��Һ����Һ��H2CO3��HCO3-��CO32-�����ֲַ�����![]() (X)=
(X)=![]() ��pH�Ĺ�ϵ��ͼ��ʾ��
��pH�Ĺ�ϵ��ͼ��ʾ��

����˵����ȷ����
A. ��ӦHCO3-![]() H����CO32-��lgK=-6.4
H����CO32-��lgK=-6.4
B. pH�T8����Һ�У�c��Na����>c��HCO3-��
C. NaHCO3��Һ�е���������������Һ�����ԣ�c��Na�����Tc��Cl-��
D. ��pH=6.4����Һ�еμ�NaOH��Һ��pH=8����Ҫ���������ӷ�Ӧ��HCO3-��OH-�TCO32-��H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ�ǿ���С����Ƶ��û�ѧ��ԴʹLED�Ʒ����װ�á�����˵����ȷ����

A. п�Ǹ��������Ӵ�ͭƬ����������пƬ
B. ͭƬ�ϵĵ缫��ӦʽΪ2H+ + 2e- =H2��
C. �����ͭƬ������Ƭ����·�еĵ������ı�
D. װ����ֻ��������ѧ������������ת��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����20mL bmol��L��1KOH��Һ����μ���0.1mol��L��1������Һ����ҺpH�ͼ������������ϵ������ͼ��ʾ�����й�ϵ����ȷ����
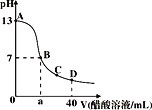
A. a=20
B. b=0.1
C. ��C�㣺c(CH3COO��)��c(K+)��c(H+)��c(OH��)
D. ��D�㣺c(CH3COO��)+c(CH3COOH)=2c(K+)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ԫ�����ڱ���Ԫ�������ɣ��ж�������������ȷ����

A. ��̬�⻯����ȶ��ԣ�H2O��NH3��SiH4
B. ��Ԫ��������Ԫ�ؿ��γɹ��ۻ���������ӻ�����
C. ��ͼ��ʾʵ���֤��Ԫ�صķǽ����ԣ�Cl��C��Si
D. ��������![]() ������o�������ĵ�118��Ԫ�������ڱ���λ�ڵ�������0��
������o�������ĵ�118��Ԫ�������ڱ���λ�ڵ�������0��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ����ȷ����(����)
A. ��ȩ��Һ������������ͭ��������Һ���ȣ� CH3CHO + 2Cu(OH)2 + OH- ![]() CH3COO- + Cu2O��+ 3H2O
CH3COO- + Cu2O��+ 3H2O
B. ̼������Һ����ᷴӦ��CO32- + 2H+ = CO2��+ H2O
C. ��Fe��ȥFeCl2��Һ�е�������FeCl3���ʣ�Fe��Fe3+��2Fe2+
D. ��1~2mL�Ȼ���������Һ�ӵ�20mL��ˮ�У�Fe3+ + 3H2O = Fe(OH)3(����) + 3H+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ��һ�绯ѧʵ��װ��,ͼ��C��D��Ϊ���缫��UΪ���ţ�G�����������ƣ���ָ������ƫ���Դ������

(1)As(��)λ��Ԫ�����ڱ��е�4���ڵڢ�A�壬��Na3AsO4��Һ��pH_________(�>����<����=��)7��
(2)��B���м���������Ũ�����ᣬ����G��ָ������ƫ�ơ���ʱA���е���Ҫʵ��������_____��D�缫�ϵĵ缫��ӦʽΪ___________��
(3)һ��ʱ�������B���м�����������������Ϊ40%������������Һ������G��ָ������ƫ�ơ���ʱ����ʵ��װ�õ��ܵ����ӷ���ʽΪ________________��
(4)�ٹ�һ��ʱ���G��ָ�����㣬��ʱʵ��װ���еĻ�ѧ��Ӧ�Ѿ��ﵽ��ѧƽ��״̬���÷�Ӧ�Ļ�ѧƽ�ⳣ���ı���ʽΪ��K=________________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com