
下列说法中正确的是( )
A.中子数为18的氯原子可表示为18Cl
B.盐酸和食醋既是化合物又是酸
C、可以通过过滤的方法将淀粉胶体中混有的氯化钠溶液除去
D.6.8 g熔融KHSO4与3.9 g熔融Na2O2中阴离子数目相同
 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案科目:高中化学 来源:2015-2016学年河南省高一上学期12月月考化学试卷(解析版) 题型:选择题
下列与“物质的量”相关的计算正确的是( )
A.5.6 g CO和22.4 L CO2中含有的碳原子数一定相等
B.n g Cl2中有m个Cl原子,则阿伏加德罗常数NA的数值可表示为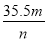
C.标准状况下,11.2L M气体分子的质量为16 g,则M气体的摩尔质量是32
D.现有CO、CO2、O3三种气体,它们均含有1 mol O,则三种气体的物质的量之比为3∶2∶1
查看答案和解析>>
科目:高中化学 来源:2016届江苏省高三上第二次阶段测化学试卷(解析版) 题型:选择题
热激活电池可用作火箭、导弹的工作电源。一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能。该电池总反应为PbSO4+2LiCl+Ca=CaCl2+Li2SO4+Pb。下列有关说法正确的是
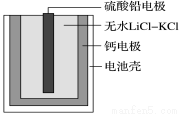
A.正极反应式:Ca+2Cl--2e-=CaCl2
B.放电过程中,Li+向负极移动
C.常温时,在正负极间接上电流表或检流计,指针发生偏转
D.每转移0.1 mol电子,理论上生成10.35 g Pb
查看答案和解析>>
科目:高中化学 来源:2016届辽宁省沈阳市四校协作体高三上学期期中联考化学试卷(解析版) 题型:选择题
Bodensteins研究了下列反应:2HI(g) H2(g) + I2(g) △H=+11kJ/mol
H2(g) + I2(g) △H=+11kJ/mol
在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:
t/min | 0 | 20 | 40 | 60 | 80 | 120 |
x(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
x(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
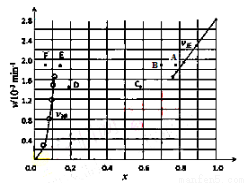
由上述实验数据计算得到v正~x(HI)和v逆~x(H2)的关系可用下图表示。当升高到某一温度时,反应重新达到平衡,相应的点分别为:
A.B F B.A E C.B E D.A D
查看答案和解析>>
科目:高中化学 来源:2016届上海市十三校高三上学期第一次联考化学试卷(解析版) 题型:选择题
已知 ①同温度下的溶解度;Zn(OH)2 > ZnS,MgCO3 > Mg(OH)2;②溶解或电离出S2-的能力:FeS > H2S > CuS,则下列离子方程式错误的是
A.Mg2+ + 2HCO3-+ 2Ca2+ + 4OH- → Mg(OH)2↓+2CaCO3↓+2H2O
B.Zn2+ + S2-+ 2H2O → Zn(OH)2↓+ H2S↑
C.Cu2+ + H2S → CuS↓+ 2H+
D.FeS + 2H+ → Fe2++ H2S↑
查看答案和解析>>
科目:高中化学 来源:2016届浙江省高三上学期第三次月考化学试卷(解析版) 题型:选择题
铝电池性能优越,Al-AgO电池可用作水下动力电源,其原理如图所示。该电池反应的化学方程式为:2Al+3AgO+2NaOH=2NaAlO2+3Ag+H2O,则下列说法正确的是
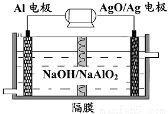
A.该隔膜是阳离子交换膜
B.当电极上析出1.08 g Ag时,电路中转移的电子为0.01 mol
C.Al电极的反应式为:Al-3e-+4OH-= AlO2-+2H2O
D.正极的电极反应式为:O2+2H2O+4e-=4OH-
查看答案和解析>>
科目:高中化学 来源:2016届贵州省高三上学期第三次月考理综化学试卷(解析版) 题型:填空题
氮及其化合物在生活、生产和科技等方面有重要的应用。砷位于周期表中的第四周期,与氮元素属同一主族元素,其广泛分布与自然界。试回答下列问题:
(1)砷的气态氢化物的电子式为 。
(2)氨和联氨(N2H4)是氮的两种常见化合物,制备联氨可用丙酮做催化剂,将次氯酸钠与氨气反应,该反应中还原剂与氧化剂的物质的量之比为2:1,写出该反应的化学方程式: 。
(3)砷的常见酸性氧化物有As2O3和As2O5,请根据图相关信息写出分解为的热化学方程式: 。
(4)直接供氨式碱性燃料电池的电池反应式为4NH2+3O2=2N2+6H2O,电解 质溶液一般使用氢氧化钾溶液,则负极电极反应式为 。
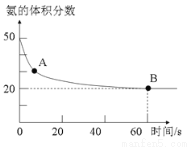
(5)氨气和二氧化碳在120℃,催化剂作用下反应生成尿素:CO2(g)+2NH3(g) 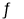 (NH2)2CO(s)+H2O(g),在密闭反应容器中,混合气体中氨气的含量变化关系如图所示,则氨气的平衡转化率是 。
(NH2)2CO(s)+H2O(g),在密闭反应容器中,混合气体中氨气的含量变化关系如图所示,则氨气的平衡转化率是 。
(6)将一定量的NH2COONH4(s)置于恒温密闭容器中,NH2COONH4(s) 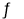 2NH3(g)+CO2(g),其分解达到平衡状态时,该反应的化学平衡常数的表达式为 。
2NH3(g)+CO2(g),其分解达到平衡状态时,该反应的化学平衡常数的表达式为 。
(7)在容积恒定的密闭容器中进行反应2NO(g)+O2(g) 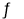 2NO2(g) △H>0,该反应的反应速率(v)随时间(t)变化的关系如图所示,若t2、t4时刻只改变一个条件,下列说法正确的是 (填序号)
2NO2(g) △H>0,该反应的反应速率(v)随时间(t)变化的关系如图所示,若t2、t4时刻只改变一个条件,下列说法正确的是 (填序号)
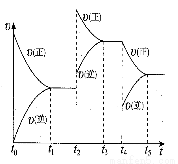
a.在t1-t2时,可依据容器内气体的压强保持不变判断反应已达到平衡状态
b.在t2时,采取的措施可以是升高温度
c.在t3-t4时,可依据容器内气体的密度保持不变判断反应已达到平衡状态
d.在t5时,容器内NO2的体积分数是整个过程中的最大值
查看答案和解析>>
科目:高中化学 来源:2015-2016学年福建省高二上学期期中考试化学试卷(解析版) 题型:选择题
可逆反应N2(g)+3H2(g) 2NH3(g),△H=-Q KJ/mol(Q>0)。有甲、乙两个容积相同且不变的密闭容器,向甲容器中加入1molN2和3molH2,在一定条件下达到平衡时放出热量为Q1KJ;在相同条件下,向乙容器中加入2molNH3达到平衡后吸收热量为Q2KJ,已知甲和乙两容器中所达到的平衡完全相同且Q1=4Q2。下列叙述不正确的是( )
2NH3(g),△H=-Q KJ/mol(Q>0)。有甲、乙两个容积相同且不变的密闭容器,向甲容器中加入1molN2和3molH2,在一定条件下达到平衡时放出热量为Q1KJ;在相同条件下,向乙容器中加入2molNH3达到平衡后吸收热量为Q2KJ,已知甲和乙两容器中所达到的平衡完全相同且Q1=4Q2。下列叙述不正确的是( )
A.达平衡时,两容器中反应物的转化率不同,甲中N2和H2为80%,乙中NH3为20%
B.甲中NH3的体积分数与乙相等
C.达到平衡后,再向乙中加入0.2moLN2、0.6molH2、1.6molNH3,平衡向生成NH3的方向移动
D.乙中的热化学反应方程式为2NH3(g) N2(g)+3H2(g);△H=+Q2KJ/mol
N2(g)+3H2(g);△H=+Q2KJ/mol
查看答案和解析>>
科目:高中化学 来源:2015-2016学年安徽省五校高一上第一次月考化学试卷(解析版) 题型:选择题
下列溶液中,能大量共存的离子组是( )
A.Ba2+、Cu2+、C1﹣、NO3﹣ B.Ca2+、Al3+、Br﹣、ClO﹣
C.NH4+、K+、HSO3﹣、CO32﹣ D.Na+、K+、MnO4﹣、I﹣
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com