
| A. | ①④ | B. | ③⑤ | C. | ①②③④⑤ | D. | ①②③⑤ |
分析 元素金属性强弱判断方法有:金属的金属性越强其最高价氧化物的水化物碱性越强,活动性较强的金属能置换出较不活泼的金属,金属的金属性越强其单质与酸或水反应越剧烈,据此分析解答.
解答 解:元素金属性强弱判断方法有:金属的金属性越强其最高价氧化物的水化物碱性越强,活动性较强的金属能置换出较不活泼的金属,金属的金属性越强其单质与酸或水反应越剧烈,
①甲跟水反应比乙与水反应剧烈,说明甲的金属性比乙强,故正确;
②甲单质能从乙的盐溶液中置换出单质乙,说明甲的金属性大于乙,故正确;
③甲的最高价氧化物的水化物碱性比乙的最高价氧化物的水化物碱性强,说明甲的金属性大于乙,故正确;
④与某非金属反应时甲原子失电子数目比乙的多,与金属性强弱无关,如铝、镁分别与氯气反应时,铝原子失电子比镁原子多,但镁的金属性大于铝,故错误;
⑤以甲、乙金属为电极构成原电池,甲作负极,原电池中,较活泼的金属作负极、较不活泼的金属作正极,所以甲的金属性大于乙,故正确;
故选D.
点评 本题考查金属的金属性强弱判断,为高考高频点,明确金属性、非金属性强弱判断方法是解本题关键,注意金属性强弱只与失电子难易程度有关,与失电子多少无关.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
 1866年凯库勒(如图)提出了苯的单、双键交替的正六边形平面结构,解释了苯的部分性质,但还有一些问题尚未解决,它不能解释下列事实( )
1866年凯库勒(如图)提出了苯的单、双键交替的正六边形平面结构,解释了苯的部分性质,但还有一些问题尚未解决,它不能解释下列事实( ) | A. | ①③⑤ | B. | ①②③④⑤ | C. | ①③④⑤ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 时间/min | n(X)/mol | n(Y)/mol | n(Z)/mol |
| 0 | 0.20 | 0.60 | 0 |
| 10 | a1 | a2 | 0.25 |
| 13 | b1 | 0.45 | b2 |
| 15 | d1 | d2 | 0.30 |
| A. | 前10 min内的平均反应速率v(Y)=2.5×10-3 mol/(L•min) | |
| B. | 保持其它条件不变,升高温度,反应达平衡时c(X)<5.0×10-3 mol/L | |
| C. | 若起始时只充入0.60 mol Z(g),反应达平衡时Z(g)的转化率为50% | |
| D. | 若起始时充入0.60 mol X(g)、0.10 mol Y(g)和0.50 mol Z(g),达到平衡前v(正)>v(逆) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 碳氧化物的转化有重大用途,回答关于CO和CO2的问题.
碳氧化物的转化有重大用途,回答关于CO和CO2的问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
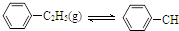 =CH2(g)+H2(g)△H=a kJ•mol-1下列说法正确的是( )
=CH2(g)+H2(g)△H=a kJ•mol-1下列说法正确的是( )| 时间/min | 0 | 10 | 20 | 30 | 40 |
| n(乙苯)/mol | 0.40 | 0.30 | 0.24 | n2 | n3 |
| n(苯乙烯)/mol | 0.00 | 0.10 | n1 | 0.20 | 0.20 |
| A. | 保持其他条件不变,向容器中充入不参与反应的水蒸气作为稀释剂,则乙苯的转化率大于50% | |
| B. | 反应在前20 min的平均速率为v(H2)=0.004mol•L-1•min-1 | |
| C. | 保持其他条件不变,升高温度,平衡时,c(乙苯)=0.08mol•L-1,则a<0 | |
| D. | 相同温度下,起始时向容器中充入0.10mol乙苯、0.10mol苯乙烯和0.30molH2,达到平衡前v(正)>v(逆) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 在催化剂作用下,由苯和下列各组物质合成乙苯最好应选用的是( )
在催化剂作用下,由苯和下列各组物质合成乙苯最好应选用的是( )| A. | CH3-CH3和Cl2 | B. | CH2=CH2和Cl2 | C. | CH2=CH2和HCl | D. | CH≡CH和Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由非电解质溶于水得到的溶液 | |
| B. | c(H+)、c(OH-)均为5.0×10-7mol•L-1的溶液 | |
| C. | 等物质的量的强酸与强碱反应得到的溶液 | |
| D. | 将pH=9的烧碱溶液稀释100倍所得到的溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com