
| A. | 只由一种元素的阳离子与另一种元素的阴离子组成的物质不一定是纯净物 | |
| B. | 用加热的方法可以除去混在NaCl固体中的NH4Cl,说明NH4Cl会升华 | |
| C. | SO2气体和Cl2均能使品红溶液褪色,说明两者均有强氧化性 | |
| D. | 浓硫酸不能用来干燥HI、CO、SO2等气体,因为浓硫酸具有强氧化性 |
分析 A.纯净物是由一种物质构成的物质,只由一种元素的阳离子与另一种元素的阴离子组成的物质不一定为纯净物;
B.氯化铵受热分解生成氯化氢和氨气,上升过程中相遇会生成固体氯化铵,升华是物质三态变化属于物理变化;
C.二氧化硫与有色物质发生化合反应生成无色物质,没有发生氧化还原反应;
D.浓硫酸具有吸水性,能作干燥剂.
解答 解:A.对于离子化合物来说,一种阳离子和一种阴离子只能得到一种物质(电荷守恒),当阴、阳离子个数比不同时,其组成物质的种类可能是多种,如FeCl3与FeCl2,故A错误;
B.用加热的方法可以除去混在NaCl固体中的NH4Cl,说明NH4Cl易分解,氯化氢和氨气易发生反应,不是升华,故B错误;
C.二氧化硫一般表现为还原性,与有色物质发生化合反应而漂白,但不稳定,加热时可恢复到原来的颜色,不是氧化还原反应,故C错误;
D.浓硫酸不和H2、Cl2、SO2等气体反应,浓硫酸可用来干燥H2、Cl2、SO2等气体,说明浓硫酸的吸水性,故D正确;
故选D.
点评 本题综合考查元素化合物知识,为高频考点,侧重于基础知识的综合理解和运用的考查,注意相关基础知识的积累,题目难度不大.


 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 某化学活动小组设计实验(装置如图)验证氯、溴、碘及其化合物的有关物质.在硬质玻璃管中的A、B、C三处依次放置湿润的蓝色石蕊试纸、浸有NaBr溶液的棉球、浸有淀粉-KI溶液的棉球(如图所示),由左端通入足量氯气,回答下列问题:
某化学活动小组设计实验(装置如图)验证氯、溴、碘及其化合物的有关物质.在硬质玻璃管中的A、B、C三处依次放置湿润的蓝色石蕊试纸、浸有NaBr溶液的棉球、浸有淀粉-KI溶液的棉球(如图所示),由左端通入足量氯气,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
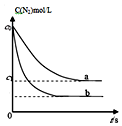 汽车尾气中,产生NO的反应为:N2(g)+O2(g)?2NO(g),一定条件下,等物质的量的N2(g)和O2(g)在恒容密闭容器中反应,如图曲线a表示该反应在温度T下N2的浓度随时间的变化,曲线b表示该反应在某一起始条件改变时N2的浓度随时间的变化.下列叙述正确的是( )
汽车尾气中,产生NO的反应为:N2(g)+O2(g)?2NO(g),一定条件下,等物质的量的N2(g)和O2(g)在恒容密闭容器中反应,如图曲线a表示该反应在温度T下N2的浓度随时间的变化,曲线b表示该反应在某一起始条件改变时N2的浓度随时间的变化.下列叙述正确的是( )| A. | 若曲线b对应的条件改变是温度,可判断该反应的△H<0 | |
| B. | 温度T下,随着反应的进行,混合气体的密度减小 | |
| C. | 曲线b对应的条件改变可能是加入了催化剂 | |
| D. | 温度T下,该反应的平衡常数K=$\frac{4({c}_{0}-{c}_{1})^{2}}{{c}_{1}^{2}}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯、苯、环己烷都属于脂肪烃 | B. | 苯、环戊烷、环己烷同属于芳香烃 | ||
| C. | 乙烯、乙炔同属于烯烃 | D. |  、 、 、 、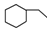 同属于环烷烃 同属于环烷烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2H2O$\frac{\underline{\;通电\;}}{\;}$ 2H2↑+O2 | B. | 2Na+2H2O═2NaOH+H2↑ | ||
| C. | Cl2+H2O═HC1+HC1O | D. | 2F2+2H2O═4HF+O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
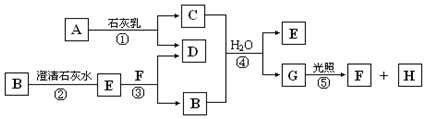 图中A~H均为中学化学中常见的物质,A、B、H是气体,它们之间有如图转化关系(反应中生成的水已略去).
图中A~H均为中学化学中常见的物质,A、B、H是气体,它们之间有如图转化关系(反应中生成的水已略去).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
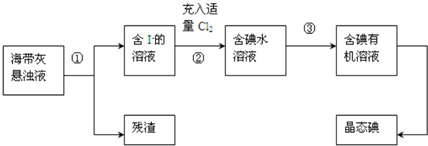
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com