
【题目】(1)观察下列A、B、C、D、E五种粒子(原子或离子)的结构示意图,回答有关问题。
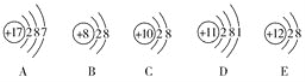
①与离子相对应的元素符号是______________,与原子相对应的离子的结构示意图是______________。
②电子层结构相同的是__________(填写代号,下同),性质最稳定的是__________,最容易失去电子的是__________,最容易得到电子的是__________。
③可直接相互结合形成的化合物的化学式是____________。可经过得失电子后再相互结合形成的化合物的化学式是______________。
④在核电荷数1~10的元素内,列举两个与B电子层结构相同的离子,写出离子的符号______________。
(2)已知元素X和Y的核电荷数均小于18,最外层电子数分别为n和(m-5),次外层有(n+2)个和m个电子,据此推断元素X和Y,其名称为X__________,Y__________。
【答案】O、Mg 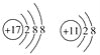 BCE C D A MgO NaCl N3-、F- 硫 铝
BCE C D A MgO NaCl N3-、F- 硫 铝
【解析】
(1)由原子或离子示意图可知:A为氯原子,B为氧离子,C为氖原子,D为钠原子,E为镁离子;据此回答;
(2)根据核外电子排布规律分析解答。
(1)由原子或离子示意图可知:A为氯原子,B为氧离子,C为氖原子,D为钠原子,E为镁离子;则
①与离子相对应的元素符号是O、Mg;与原子相对应的离子的结构示意图是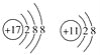 ;故答案为:O、Mg;
;故答案为:O、Mg; ;
;
②电子层结构相同的是BCE,C为稀有气体,最稳定;钠原子最外层只有一个电子最容易失去电子,氯原子最外层为7电子最容易得到电子;故答案为:BCE;C;D;A;
③Mg2+和O2-可直接相互结合形成的化合物的化学式是MgO;Na原子和Cl原子可经过得失电子后再相互结合形成的化合物的化学式是NaCl;故答案为:MgO;NaCl;
④在核电荷数1~10的元素内,与氧离子电子层结构相同的离子有N3-、F-;故答案为:N3-、F-;
(2)元素X和Y的核电荷数均小于18,最外层电子数分别为n和(m-5),次外层有(n+2)个和m个电子,次外层可能为2或8,当次外层为2时m=2,Y最外层为-3不符,所以次外层为8,则m=8,n=6,则最外层X为6,Y为3,所以X为S,Y为Al。故答案为:硫;铝。


科目:高中化学 来源: 题型:
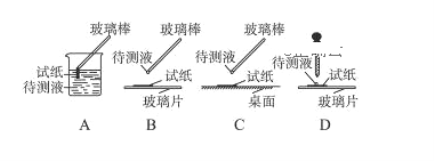
【题目】某无色透明溶液可能含有下列离子:K+、Al3+、Fe3+、Ba2+、NO3-、SO42-、HCO3-、Cl-等,取该溶液进行如下实验:
①用蓝色石蕊试纸检测该溶液,试纸显红色;
②取溶液少许,加入铜片和稀硫酸共热,产生无色气体,该气体遇到空气立即变为红棕色;
③取溶液少许,加入氨水有白色沉淀生成,继续加入过量氨水,沉淀不消失;
④取溶液少许,滴入氯化钡溶液产生白色沉淀;
⑤取实验④后的澄清溶液,滴入硝酸银溶液产生白色沉淀,再加入过量的稀硝酸,沉淀不消失。
请回答下列问题:
(1)在实验①中,下图所示的操作中正确的是________________(填代号)。
(2)根据上述实验判断原溶液中肯定存在的离子是__________,肯定不存在的离子是_________。
(3)写出与②和③两个实验有关的离子方程式:
②______________________________,③_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】霉酚酸是一种生物活性化合物。下列有关霉酚酸的说法正确的是( )
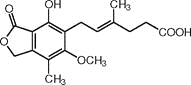
A.分子式为:C17H20O6
B.处于同一平面的碳原子至多9个
C.只有2个官能团
D.一定条件下, 1 mol霉酚酸最多可与3 mol H2反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是由常见元素组成的一些单质及其化合物之间的转化关系图。各方框表示有关的一种反应物或生成物(部分物质已经略去)。其中A、B、D在常温下均为无色无味的气体,C是能使湿润的红色石蕊试纸变蓝的气体,M是最常见的无色液体。

(1)写出C→E的化学方程式: 。
(2)实验室常用加热两种固体混合物的方法制备物质C,其化学方程式为: ,干燥C常用 (填写试剂名称)。
(3)E物质遇到D物质时,会观察到 现象,若用排水法收集F,则最终集气瓶中收集到的气体为 (填写物质的化学式)。
(4)写出A→D的化学方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】熔融碳酸盐燃料电池简称MCFC ,具有高发电效率,工作原理示意图如图。下列有关说法正确的是
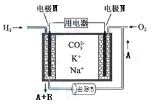
A. 电极M为负极,K+、Na+移向M
B. 电池工作时,熔融盐中CO32-物质的量增大
C. A 为CO2,正极的电极反应为:O 2+4e -+2CO2 = 2CO32 -
D. 若用MCFC给铅蓄电池充电,电极N接Pb极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一含NaCl、Na2CO3·10H2O和NaHCO3的混合物,某同学设计如图所示的实验装置,通过测量反应产生的CO2和H2O的质量,来确定该混合物中各组分的质量分数。

(1)实验步骤:
①按图(夹持仪器未画出)组装好实验装置后,首先进行的操作是__________。
②称取样品,并将其放入硬质玻璃管中,称量装浓硫酸的洗气瓶C的质量和装碱石灰的U形管D的质量。
③打开活塞K1、K2,关闭K3,缓缓鼓入空气数分钟,其目的是________。
④关闭活塞K1、K2,打开K3,点燃酒精灯加热至不再产生气体。装置B中发生反应的化学方程式为________、________。
⑤打开活塞K1,缓缓鼓入空气数分钟,然后拆下装置,再次称量洗气瓶C的质量和U形管D的质量。
(2)关于该实验方案,请回答下列问题。
①若加热反应后不鼓入空气,对测定结果的影响是_______________。
②E处干燥管中盛放的药品是碱石灰,其作用是_____________,如果实验中没有该装置,则会导致测量结果NaHCO3的质量_____________(填“偏大”“偏小”或“无影响”)。
③若样品质量为w g,反应后C、D装置增加的质量分别为m1g、m2g,则混合物中Na2CO3·10H2O的质量分数为________(用含w、m1、m2的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上通常利用SiO2 和碳反应来制取硅,写出反应的化学方程式___________________。
工业上还可以利用镁制取硅,反应为2Mg+SiO2 = 2MgO+Si,同时会发生副反应:2Mg + Si = Mg2Si。如图是进行Mg与SiO2反应的实验装置,试回答下列问题:

(1)由于O2和H2O(g)的存在对该实验有较大影响,实验中应通入气体X作为保护气,试管中的固体药品可选用________(填序号)。
a.石灰石 b.锌粒 c.纯碱
(2)实验开始时,必须先通一段时间X气体,再加热反应物,其理由是 ___________________________;当反应引发后,移走酒精灯,反应能继续进行,其原因是______________________。
(3)反应结束后,待冷却至常温时,往反应后的混合物中加入稀盐酸,可观察到闪亮的火星,产生此现象的原因是副产物Mg2Si遇盐酸迅速反应生成SiH4(硅烷)气体,然后SiH4自燃.用化学方程式表示这两个反应①________________________②___________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】填写下表中的空格:
微粒符号 | 质子数 | 中子数 | 电子数 | 质量数 |
| _______ | ___________ | ____________ | _____________ |
________ | 18 | 20 | _______________ | __________ |
____________ | ___________ | 16 | 18 | 32 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白磷(P4)的正四面体结构如图所示,能与Ba(OH)2溶液发生反应: 2P4+3Ba(OH)2 + 6H2O=3Ba(H2PO2)2 +2PH3↑。若该反应消耗白磷3.1g,则下列说法正确的是( )
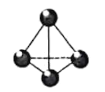
A.水是还原剂,消耗水的质量为1.35g
B.产生PH3,气体560mL
C.转移0. 75 mol电子
D.反应断开了0.15 molP-P键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com