
| A. | ①②③⑤⑧ | B. | ②④⑥⑦⑨ | C. | ①③⑤⑥⑦ | D. | ①②④⑧ |
分析 ①T2O的摩尔质量为22/mol;
②求出C3H8的物质的量,然后根据1mol丙烷中含10mol共价键来分析;
③Na2O2与CO2的反应为歧化反应;
④求出硅的物质的量,然后根据1mol硅中含2molSi-Si键来分析;
⑤Cl2所处的状态不明确;
⑥Al3+是弱碱阳离子,在溶液中会水解;
⑦在常温常压下,0.1mol铁与0.1mol Cl2充分反应,铁过量;
⑧O2和O3均由氧原子构成;
⑨C16O与C18O的摩尔质量分别为28g/mol和30g/mol.
解答 解:①T2O的摩尔质量为22/mol,故22gT2O物质的量为1mol,则含10NA个电子,故正确;
②0.44gC3H8的物质的量为0.01mol,而1mol丙烷中含10mol共价键,故0.01mol丙烷中含0.1mol共价键即0.1NA个,故正确;
③Na2O2与CO2的反应为歧化反应,故1mol过氧化钠转移1mol电子即NA个,故错误;
④28g硅的物质的量为1mol,而1mol硅中含2molSi-Si键,即2NA个,故正确;
⑤Cl2所处的状态不明确,故11.2L氯气的物质的量不一定是0.5mol,则反应后转移的电子数不一定是0.5NA个,故错误;
⑥Al3+是弱碱阳离子,在溶液中会水解,故溶液中的铝离子、硫酸根的个数之和小于NA个,故错误;
⑦在常温常压下,0.1mol铁与0.1mol Cl2充分反应,铁过量,由于氯气反应后变为-1价,故当0.1mol氯气反应完时反应转移0.2mol电子即0.2NA个,故错误;
⑧O2和O3均由氧原子构成,故6.4g混合物中含有的氧原子的物质的量为n=$\frac{6.4g}{16g/mol}$=0.4mol,个数为0.4NA个,故正确;
⑨C16O与C18O的摩尔质量分别为28g/mol和30g/mol,故28g C16O与28g C18O的物质的量之比为30:28=15:14,而C16O与C18O中均含14个质子,两者中的质子数之比为15:14,故错误;
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | Na2O作呼吸面具中的供氧剂 | B. | 小苏打做发酵粉 | ||
| C. | 镁合金用于制造汽车、飞机、火箭 | D. | 漂白粉做消毒剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
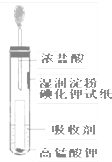 在实验室里,第一位同学取一小块金属钠做与水反应的实验.试完成下列问题:
在实验室里,第一位同学取一小块金属钠做与水反应的实验.试完成下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳的燃烧热△H<-110.5 kJ/mol | |
| B. | ①的反应热为221 kJ/mol | |
| C. | 稀硫酸与稀NaOH溶液反应的中和热△H=-2×57.3 kJ/mol | |
| D. | 稀醋酸和稀NaOH溶液反应生成1 mol H2O,放出57.3 kJ的热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 11.2 L NH3中所含的原子数为2NA | |
| B. | 2.4g金属镁变为Mg2+时失去的电子数为0.1 NA | |
| C. | 常温常压下,1.06g Na2CO3含有的Na+离子数为0.02 NA个 | |
| D. | 物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl-个数为NA个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③⑤ | B. | ②③ | C. | ②④ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 配料 | 精盐、碘酸钾(KIO3)、抗结剂 |
| 碘含量 | 35±15mg/kg |
| 储存方法 | 密封、避光、防潮 |
| 食用方法 | 烹饪时,待食品熟后加入碘盐 |
| A. | 高温会导致碘的损失 | B. | 碘酸钾可氧化氯化钠 | ||
| C. | 可用淀粉检验碘盐中的碘酸钾 | D. | 该碘盐中碘含量是指碘酸钾的含量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 150ml 1mol/L氯化钠溶液 | B. | 150ml 3mol/L氯化钾溶液 | ||
| C. | 75ml 2mol/L氯化铵溶液 | D. | 50ml 1mol/L氯化钡溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com