


科目:高中化学 来源: 题型:
| A、常温常压下,71gCl2和73gHCl中所含氯原子都是2NA |
| B、在非标准状况下,1mol任何气体的体积不可能是22.4L |
| C、标准状况下,22.4LH2和O2的混合气体中含分子总数为2NA |
| D、10℃时,1molO2的体积一定大于22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:

| ① | ② | ③ | ④ | |
| A | NaCl | Na2SO4 | KCl | Mg(NO3)2 |
| B | Na2SO4 | K2SO4 | KCl | MgCl2 |
| C | NaCl | K2SO4 | KCl | MgCl2 |
| D | Na2SO4 | K2SO4 | KCl | Mg(NO3)2 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用氢氟酸来刻蚀玻璃器皿 |
| B、用活性炭去除冰箱中的异味 |
| C、用煤液化和气化得到清洁燃料 |
| D、用热碱溶液清除炊具上残留的油污 |
查看答案和解析>>
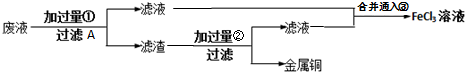
科目:高中化学 来源: 题型:
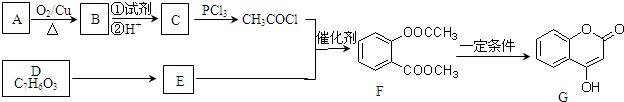
| PCl3 |
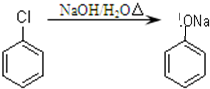 )制取苯酚,而酚羟基一般不易直接与羧酸酯化.苯甲酸苯酚酯(
)制取苯酚,而酚羟基一般不易直接与羧酸酯化.苯甲酸苯酚酯(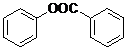 )是一种重要的有机合成中间体.试写出以苯、甲苯为原料制取该化合物的合成路线流程图(无机原料任用).
)是一种重要的有机合成中间体.试写出以苯、甲苯为原料制取该化合物的合成路线流程图(无机原料任用).| O2 |
| 催化剂 |
| CH3CH2OH |
| 浓H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
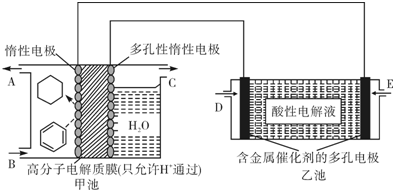
| A、乙池中溶液的pH变大 |
| B、E处通入H2,C处有O2放出 |
| C、甲池中阴极区只有苯被还原 |
| D、导线中共传导11.2mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(H+):c(OH-)=1:10-2的溶液中K+、Ba2+、ClO-、CO32-一定能大量存在 | ||
| B、水电离出来的c(H+)=10-13mol/L的溶液中K+、Cl-、NO3-、I-一定能大量存在 | ||
C、往0.1mol/LCH3COOH溶液中通人少量HCl,醋酸的电离平衡向逆反应方向移动,且溶液中
| ||
| D、等物质的量浓度的下列溶液:①H2CO3②Na2CO3③NaHCO3④(NH4)2CO3⑤NH4HCO3中c(CO32-)的大小关系为:②>④>③>⑤>① |
查看答案和解析>>
科目:高中化学 来源: 题型:
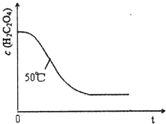 某小组利用H2C204溶液和酸性KMn04溶液反应来探究“条件对化学反应速率的影响”.
某小组利用H2C204溶液和酸性KMn04溶液反应来探究“条件对化学反应速率的影响”.| 实验序号 | 反应温度/℃ | H2C2O4溶液 | 酸性KMnO4溶液 | H2O | ||
| V/mL | c/(mol?L-1) | V/mL | c/(mol?L-1) | V/mL | ||
| ① | 25 | 8.0 | 0.20 | 5.0 | 0.010 | 0 |
| ② | 25 | 6.0 | 0.20 | 5.0 | 0.010 | x |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com