
【题目】NA表示阿伏加德罗常数的数值,下列说法正确的是
A. 在标准状况下,11.2L HF含有的分子数目为0.5NA
B. 高温下,16.8 g Fe与足量水蒸气完全反应失去0.8NA个电子
C. 常温下,0.2 L 0.5 mol·L-1 NH4NO3溶液中含有的氮原子数小于0.2NA
D. 18g葡萄糖(C6H12O6)分子含有的羟基数目为0.6NA
 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:
【题目】(1) 与氢气反应的化学方程式是__________;
与氢气反应的化学方程式是__________;
(2)写出正戊烷CH3(CH2)3CH3的两种同分异构体的结构简式和名称(系统命名法):
①结构简式:_____________、名称:_____________
②结构简式:_____________、名称:_____________。
(3)某一氯代烷烃分子中有2个“-CH3”、2个“-CH2-”、1个“ ”和1个“-Cl”,符合上述条件的有机物共四种,写出它们的结构简式:
”和1个“-Cl”,符合上述条件的有机物共四种,写出它们的结构简式:![]() 、
、 、_________、_________。
、_________、_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度恒定的条件下,在2 L容积不变的密闭容器中,发生反应:2SO2(g)+O2(g) ![]() 2SO3(g)。开始充入4 mol的SO2和2 mol的O2,10 s后达到平衡状态,此时c(SO3)=0.5 mol·L-1,下列说法不正确的是 ( )
2SO3(g)。开始充入4 mol的SO2和2 mol的O2,10 s后达到平衡状态,此时c(SO3)=0.5 mol·L-1,下列说法不正确的是 ( )
A.v(SO2)∶v(O2)=2∶1B.10 s内,v(SO3)=0.05 mol·L-1·s-1
C.SO2的平衡转化率为25%D.平衡时容器内的压强是反应前的5/6倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取。纯净的A为无色粘稠液体,易溶于水。为研究A的组成与结构,进行了如下实验:
(1)称取A9.0g,升温使其汽化,测其密度是相同条件下H2的45倍。则A的相对分子质量为:______。
(2)将此9.0gA在足量纯O2充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重5.4g和13.2g。则A的分子式为:________。
(3)另取A9.0g,跟足量的NaHCO3粉末反应,生成2.24LCO2(标准状况),若与足量金属钠反应则生成2.24LH2(标准状况)。用结构简式表示A中含有的官能团:______________________。
(4)A的核磁共振氢谱如下图:则A中含有__________种氢原子。
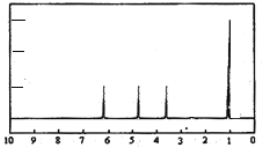
(5)综上所述,A的结构简式_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】沉淀的生成、溶解和转化在无机物制备和提纯以及科研等领域有广泛应用。已知25℃时,Ksp(BaSO4)=1×10-10,Ksp(BaCO3)=1×10-9。
(1)将浓度均为0.1 mol·L-1的BaCl2溶液与Na2SO4溶液等体积混合,充分搅拌后过滤,滤液中c(Ba2+)=_____mol·L-1。
(2)医学上进行消化系统的X射线透视时,常使用BaSO4作内服造影剂。胃酸酸性很强( pH约为1), 但服用大量BaSO4仍然是安全的,BaSO4不溶于酸的原因是_______________________。(用沉淀溶解平衡原理解释)。万一误服了少量BaCO3,应尽快用大量0.5mol·L-1Na2SO4溶液给患者洗胃,如果忽略洗胃过程中Na2SO4溶液浓度的变化,残留在胃液中的Ba2+浓度仅为________mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.1 mol S和O2的摩尔质量都是32 g
B.23g NO2和N2O4的混合气体中所含的O原子数为NA
C.1 mol任何气体中都含有相同的原子数
D.22.4 L CO2气体中含有3NA个原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸铝[Al(NO3)3]是一种常用媒染剂。工业上用铝灰(主要含Al、Al2O3、Fe2O3等)制取硝酸铝晶体[Al(NO3)3·9H2O]的流程如下:
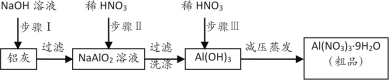
完成下列填空:
(1)常温下,铝遇浓硫酸、浓硝酸时在表面生成致密的氧化膜,这种现象称为__________,铝粉常用来还原一些金属氧化物以冶炼某些难熔的金属,这类氧化还原反应叫__________反应;
(2)步骤Ⅰ的离子方程式是_________________,_________________;
(3)若在实验室中完成步骤Ⅱ,为提高铝元素的利用率,可用__替换稀硝酸;
a.稀硫酸 b.稀盐酸 c.醋酸 d.二氧化碳
(4)在步骤Ⅲ的实际操作过程中,待沉淀完全溶解后还会加入稍过量稀硝酸,用平衡移动原理解释此时加入稀硝酸的目的:_______________________;
(5)温度高于200℃时,硝酸铝完全分解成氧化铝、二氧化氮和氧气,写出该反应的化学方程式:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为2 L的密闭容器中发生反应xA(g)+yB(g)![]() zC(g)。图甲表示200 ℃时容器中A、B、C物质的量随时间的变化,图乙表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是( )
zC(g)。图甲表示200 ℃时容器中A、B、C物质的量随时间的变化,图乙表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是( )
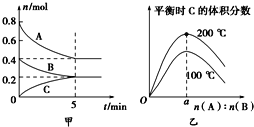
A. 200℃时,反应从开始到平衡的平均速率v(B)=0.04 mol·L-1·min-1
B. 200℃时,该反应的平衡常数为25
C. 当外界条件由200℃降温到100℃,原平衡一定被破坏,且正逆反应速率均增大
D. 由图乙可知,反应xA(g)+yB(g)![]() zC(g)的△H<0,且a=2
zC(g)的△H<0,且a=2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 0.1 mol H2中含有的分子数为6.02×1022
B. 24 g Mg变成Mg2+时失去的电子数为6.02×1023
C. 1 L 1 mol·L-1 CaCl2溶液中含有的Cl-数为6.02×1023
D. 常温常压下,11.2 L O2中含有的原子数为6.02×1023
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com