
某溶液中可能存在Br-、CO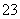 、SO
、SO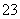 、Al3+、I-、Mg2+、Na+等7种离子中的某几种。现取该溶液进行实验,得到如下现象:
、Al3+、I-、Mg2+、Na+等7种离子中的某几种。现取该溶液进行实验,得到如下现象:
①向溶液中滴加足量氯水后,溶液变橙色,且有无色气泡冒出;②向所得橙色溶液中加入足量BaCl2溶液,无沉淀生成;③向所得溶液中继续滴加淀粉溶液,溶液不变蓝色。
据此可以判断:该溶液肯定不存在的离子组是( )
A.Al3+、Mg2+、SO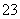
B.Mg2+、CO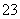 、I-
、I-
C. Al3+、SO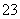 、I-
、I-
D.Al3+、Br-、SO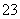
科目:高中化学 来源: 题型:
下面是以环戊烷为原料制备环戊二烯的合成路线:
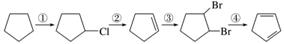
其中,反应①的产物名称是__________,反应②的反应试剂和反应条件是______________,反应③的反应类型是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
NH3、H2S等是极性分子,CO2、BF3、CCl4等是极性键形成的非极性分子。根据上述事实可推出ABn型分子是非极性分子的经验规律是( )
A.分子中不能含有氢原子
B.在ABn分子中A原子的所有价电子都参与成键
C.在ABn分子中每个共价键都相同
D.在ABn分子中A的相对原子质量应小于B的相对原子质量
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)如图,写出下列价键的名称,并各举一例说明含有这种价键类型的物质。
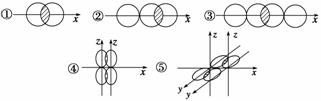
| ① | ② | ③ | ④ | ⑤ | |
| 化学键类型 | |||||
| 举例 |
(2)某有机物的结构式如下:

则分子中有________个σ键,________个π键。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组离子在指定的溶液中,能大量共存的划“√”,不能大量共存的划“×”
(1)含有大量Fe3+的溶液:Na+、SCN-、Cl-、I-( )
(2)含有大量NO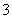 的溶液:H+、Fe2+、Cl-、SO
的溶液:H+、Fe2+、Cl-、SO ( )
( )
(3)常温下,pH=12的溶液:K+、Cl-、SO ( )
( )
(4)c(H+)=0.1 mol·L-1的溶液:Na+、NH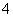 、SO
、SO 、S2O
、S2O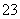 ( )
( )
(5)使pH试纸显蓝色的溶液:Cu2+、NO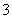 、Fe3+、SO
、Fe3+、SO ( )
( )
(6)与铝粉反应放出H2的无色溶液:NO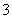 、Al3+、Na+、SO
、Al3+、Na+、SO ( )
( )
(7)使红色石蕊试纸变蓝的溶液:SO 、CO
、CO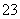 、Na+、K+( )
、Na+、K+( )
(8)常温下 =1×10-12的溶液:K+、AlO
=1×10-12的溶液:K+、AlO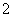 、CO
、CO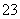 、Na+( )
、Na+( )
(9)中性溶液:Fe3+、Al3+、NO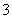 、SO
、SO ( )
( )
(10)使甲基橙变红色的溶液:Mg2+、K+、SO 、SO
、SO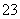 ( )
( )
(11)c(H+)水=10-12 mol·L-1的溶液:Na+、K+、CO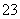 、SO
、SO ( )
( )
(12)使酚酞变红色的溶液:Na+、Cu2+、Fe2+、NO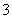 ( )
( )
(13)0.1 mol·L-1的Na2CO3溶液:Al3+、SO 、Cl-、K+( )
、Cl-、K+( )
查看答案和解析>>
科目:高中化学 来源: 题型:
下列依据相关实验得出的结论正确的是( )
A.向某溶液中加入稀盐酸,产生的气体通入澄清石灰水,石灰水变浑浊,该溶液一定是碳酸盐溶液
B.用铂丝蘸取少量某溶液进行焰色反应,火焰呈黄色,该溶液一定是钠盐溶液
C.将某气体通入溴水中,溴水颜色褪去,该气体一定是乙烯
D.向某溶液中滴加KSCN溶液,溶液不变色,滴加氯水后溶液显红色,该溶液中一定含Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
现有一瓶标签上注明为葡萄糖酸盐(钠、镁、钙、铁)的复合制剂,某同学为了确认其成分,取部分制剂作为试液,设计并完成了如下实验:

已知:控制溶液pH=4时,Fe(OH)3沉淀完全,Ca2+、Mg2+不沉淀。
该同学得出的结论正确的是( )
A.根据现象1可推出该试液中含有Na+
B.根据现象2可推出该试液中并不含有葡萄糖酸根
C.根据现象3和4可推出该试液中含有Ca2+,但没有Mg2+
D.根据现象5可推出该试液中一定含有Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于铝单质的叙述中正确的是( )
A.由于铝在空气中不会锈蚀,所以铝制品的使用寿命都很长
B.由于铝具有强还原性,所以常用铝来冶炼某些高熔点金属
C.常温下,铝被浓硫酸钝化,所以可用浓硫酸除去铝表面的铜镀层
D.由于铝的导电性能比铜强,所以常用铝制造电线、电缆
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示为一定量AlCl3溶液中加入NaOH溶液后,产生Al(OH)3白色沉淀的质量与NaOH的物质的量之间的关系曲线。
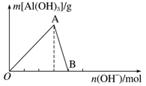
请回答下列问题:
(1)A点时已参加反应的AlCl3和NaOH的物质的量之比为__________。
(2)AB段曲线所表示的反应的离子方程式为___________________________________
________________________________________________________________________
________________________________________________________________________。
(3)向B处生成的溶液中通入二氧化碳,可观察到的现象是___________________。
(4)向含有0.1 mol NH4Al(SO4)2溶液中逐滴加入5 mol·L-1 NaOH溶液,开始发现溶液中出现白色沉淀并逐渐增多;一段时间后有刺激性气味的气体逸出;最后白色沉淀逐渐减少并最终消失。请在下图中画出生成沉淀的物质的量与加入NaOH溶液体积的关系示意图。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com