
| A、剩余固体是铁、铜混合物 |
| B、原固体混合物中铜的质量是9.6g |
| C、反应后溶液中n(Fe3+)=0.10mol |
| D、反应后溶液中n(Fe2+)+n(Cu2+)=0.75mol |
| 64g×0.5mol |
| 2mol |
| 56g×0.5mol |
| 2mol |
| 1 |
| 2 |


科目:高中化学 来源: 题型:
| A、1mol任何物质都含有约6.02×1023个原子 |
| B、0.012kg12C约含有6.02×1023个碳原子 |
| C、使用物质的量时,应用化学式且指明粒子的种类 |
| D、标准状况下,1mol H2的质量是2g,所占的体积约为22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加适量的CH3COONa晶体,两溶液的氢离子浓度都减小 |
| B、使温度升高20℃,两溶液的氢离子浓度都不变 |
| C、与等浓度的NaOH溶液反应,消耗NaOH溶液的体积一样多 |
| D、加足量的Zn充分反应后,两溶液中产生的氢气一样多 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
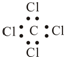
| A、全对 | B、全错 |
| C、③④⑤ | D、③④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
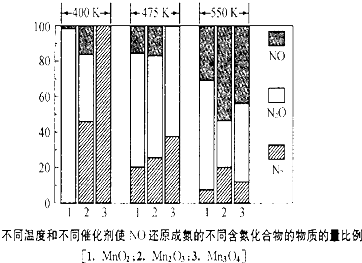
| A、在相同温度下,用不同催化剂时,消耗NH3的平均速率相同 |
| B、上述反应都是吸热反应 |
| C、生成N2的选择性,MnO2选择性最差 |
| D、将NO转化为N2适宜的温度约为400K,用Mn3O4做催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 实验室需要配制0.50mol/L NaCl溶液480mL.按下列操作步骤填上适当的文字,以使整个操作完整.
实验室需要配制0.50mol/L NaCl溶液480mL.按下列操作步骤填上适当的文字,以使整个操作完整.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com