
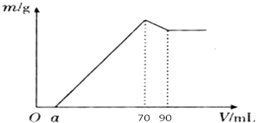
 准确称取12g铝土矿样品(含Al2O3、Fe2O3、SiO2)放入盛有100mL某浓度硫酸溶液的烧杯中,充分反应后过滤,向滤液中加入10mol?L-1的NaOH溶液,产生的沉淀质量m与加入的NaOH溶液的体积V的关系如图所示:
准确称取12g铝土矿样品(含Al2O3、Fe2O3、SiO2)放入盛有100mL某浓度硫酸溶液的烧杯中,充分反应后过滤,向滤液中加入10mol?L-1的NaOH溶液,产生的沉淀质量m与加入的NaOH溶液的体积V的关系如图所示:| n |
| V |
| 1 |
| 2 |
| 1 |
| 2 |
| 0.35mol |
| 0.1L |
| 1 |
| 2 |
| n |
| c |
| 0.054mol |
| 10mol?L -1 |
| 0.054mol |
| 3 |
| 1 |
| 2 |
| 10.2g |
| 12g |
| 0.36g |
| 12g |


 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
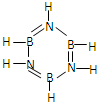 平面环状结构的(BH2N)3称为无机苯,它和苯的结构相似(如图),不存在单双键交替.则无机苯的二氯代物的同分异构体有( )
平面环状结构的(BH2N)3称为无机苯,它和苯的结构相似(如图),不存在单双键交替.则无机苯的二氯代物的同分异构体有( )| A、2种 | B、3种 | C、4种 | D、5种 |
查看答案和解析>>
科目:高中化学 来源: 题型:
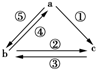 如图所示各步转化关系中,①②③反应是化合反应,④⑤反应是置换反应,则表中各物质之间不能通过一步反应实现如图所示转化关系的是( )
如图所示各步转化关系中,①②③反应是化合反应,④⑤反应是置换反应,则表中各物质之间不能通过一步反应实现如图所示转化关系的是( )| 物质 选项 | a | b | c |
| A | C | CO2 | CO |
| B | Br2 | FeBr2 | FeBr3 |
| C | Al | AlCl3 | Al2O3 |
| D | Fe | FeCl2 | FeCl3 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
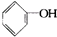 >HCO3-,下列化学方程式正确的是( )
>HCO3-,下列化学方程式正确的是( )A、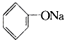 +H2O+CO2→ +H2O+CO2→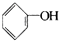 +NaHCO3 +NaHCO3 |
B、2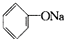 +H2O+CO2→2 +H2O+CO2→2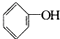 +Na2CO3 +Na2CO3 |
C、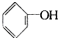 +Na2CO3→ +Na2CO3→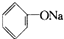 +H2CO3 +H2CO3 |
D、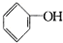 +Na2CO3→ +Na2CO3→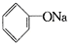 +NaHCO3 +NaHCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、68.8mL |
| B、50mL |
| C、40mL |
| D、18.8mL |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度/℃ | 400 | 500 | 830 | 1 000 |
| 平衡常数K | 10 | 9 | 1 | 0.6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com