
【题目】对于可逆反应:A(g)+3B(s)![]() 2C(g)+2D(g),在不同条件下的反应速率如下,其中表示的反应速率最大的是( )
2C(g)+2D(g),在不同条件下的反应速率如下,其中表示的反应速率最大的是( )
A.v(A)=0.5mol·L-1·min-1B.v(B)=1.2mol·L-1·s-1
C.v(D)=0.4mol·L-1·min-1D.v(C)=0.1mol·L-1·s-1
科目:高中化学 来源: 题型:
【题目】香料G的一种合成工艺如下图所示:
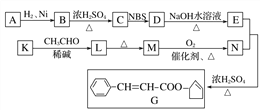
核磁共振氢谱显示A有两种峰,且峰面积之比为1∶1。
已知:CH3CH2CH===CH2![]() CH3CHBrCH===CH2
CH3CHBrCH===CH2
CH3CHO+CH3CHO![]() CH3CHOHCH2CHOCH3CHOHCH2CHO
CH3CHOHCH2CHOCH3CHOHCH2CHO![]() CH3CH===CHCHO+H2O
CH3CH===CHCHO+H2O
请回答下列问题:
(1)A的结简式为__________,G中官能团的名称为___________。
(2)检验M已完全转化为N的实验操作是____________________。
(3)有学生建议,将M→N的转化用KMnO4(H+)代替O2,老师认为不合理,原因是_______________。
(4)写出下列转化的化学方程式,并标出反应类型:
K→L:________________,反应类型:________。
(5)F是M的同系物,比M多一个碳原子。满足下列条件的F的同分异构体有________种。(不考虑立体异构)
①能发生银镜反应 ②能与溴的四氯化碳溶液加成 ③苯环上有2个对位取代基
(6)以丙烯和NBS试剂为原料制备甘油(丙三醇),请设计合成路线(其他无机原料任选)。________
请用以下方式表示:A![]() B…
B…![]() 目标产物
目标产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~I分别表示中学化学中常见的一种物质,它们之间相互关系如下图所示(部分反应物、生成物没有列出)。已知H为固态氧化物,F是红褐色难溶于水的沉淀,且A、B、C、D、E、F六种物质中均含同一种元素。

请填写下列空白:
(1)A、B、C、D、E、F六种物质中所含的同一种元素的名称是________。
(2)反应①的化学方程式为_____________________________________
反应③的离子方程式为________________________
反应⑧的化学方程式为_____________________________________
(3)反应⑥过程中的现象是______________________________。
(4)1molI发生反应后生成的A高温下与足量的水蒸气反应,生成的气体换算成标准状况下占______L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近,科学家开发出一种低成本光伏材料——蜂窝状石墨烯。生产原理是:Na2O+2CO![]() Na2CO3+C(石量烯),然后除去Na2CO3,即可制得蜂窝状石墨烯。下列说法不正确的是
Na2CO3+C(石量烯),然后除去Na2CO3,即可制得蜂窝状石墨烯。下列说法不正确的是
A. 该生产石墨烯的反应属于氧化还原反应
B. 石墨烯与金刚石互为同素异形体
C. Na2O属于碱性氧化物,CO属于酸性氧化物,Na2CO3属于盐
D. 自然界中碳元素有游离态和化合态两种存在形式
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上采用硫铁矿焙烧去硫后的烧渣(主要成分为Fe2O3、FeO、SiO2、Al2O3,不考虑其他杂质) 制取七水合硫酸亚铁(FeSO4·7H2O),流程如下:
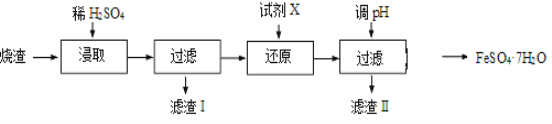
(1)浸取时,溶液中的Fe2+易被空气中的O2氧化,其离子方程式为__________________。能提高烧渣浸取速率的措施有__________________(填字母)。
A.将烧渣粉碎 B.降低硫酸的浓度 C.适当升高温度
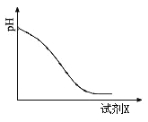
(2)还原时,试剂X的用量与溶液pH的变化如图所示,则试剂X可能是________(填字母)。还原结束时,溶液中的主要阴离子有_____________。
A.Fe粉 B.SO2 C.NaI
(3)滤渣Ⅱ主要成分的化学式为__________________;由分离出滤渣Ⅱ后的溶液得到产品,进行的操作是_______________________________ 、过滤、洗涤、干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2O2作为绿色氧化剂被应用于废水处理、造纸和化学合成等行业。
(1)已知:H2(g)+![]() O2(g)=H2O(l) ΔH1=-285.8kJ·mol-1
O2(g)=H2O(l) ΔH1=-285.8kJ·mol-1
H2(g)+O2(g)=H2O2(l) ΔH2=-135.8kJ·mol-1
①H2(g)与O2(g)的反应中,在热力学上更有利的产物是__,原因是__。
②常温下,H2O2分解的热化学方程式为__。
(2)我国科学家使用Ag9团簇作催化剂,研究H2O2的合成。各步骤的活化能和反应热,如表所示,利用计算机模拟反应历程如图所示(TS表示过渡态,表示被催化剂吸附的物种)。
Ag9团簇上生成H2O2的活化能Ea和反应热![]()
步骤 | 过渡态 | Ea/kJ |
| |
A | Ag9 | TS1 | 74.1 | +68.7 |
B | H—Ag9 | TS2 | 108.7 | -27.2 |
C | H—Ag9—H+ O2 | TS3 | 78.4 | -75.4 |
D | HOO | TS4 | 124.7 | +31.3 |

①通过降低步骤___(填字母)的能垒(活化能),可以较大幅度提高合成反应的速率。
②反应历程中2到3断裂的化学键为___(填序号)。
A.O2中的氧氧键 B.H2中的氢氢键 C.Ag9OOH中的氧氢键
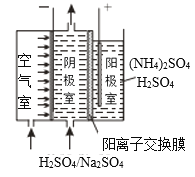
(3)利用阴阳极同步放电产生H2O2和过硫酸铵[(NH4)2S2O8]的原理如图所示。阳极上放电的离子是___,阴极的电极反应式为___。
(4)常温下,H2O2分解速率方程v=0.0625·c(H2O2)mg·L-1·s-1,c(H2O2)随时间变化如下表:
C(H2O2) (mg | 10000.0 | 8000.0 | 4000.0 | 2000.0 | 1000.0 |
分解时间(s) | 0 | 7 | 23 | 39 | 55 |
①当c(H2O2)=8000.0mg·L-1时,v=__mg·L-1·s-1;
②当c(H2O2)降为5000.0mg·L-1时,分解时间为___s。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼酸钠晶体(Na2MoO42H2O)是一种金属腐蚀抑制剂。如图是利用钼精矿(主要成分是MoS2,含少量PbS等)为原料生产钼酸钠晶体的工艺流程图。

(1) Na2MoO42H2O中钼元素的化合价是_____;在焙烧炉中,空气从炉底进入,矿石经粉碎后从炉顶进入,这样处理的目的是_____
(2)“焙烧”时MoS2转化为MoO3,写出该反应的化学方程式:_____,反应中氧化产物是_____(填化学式)。
(3)“浸取”时含钼化合物发生反应的离子方程式为___________;“结晶”前需向滤液中加入Ba(OH)2固体以除去CO32-。若滤液中c(MoO42-)= 0.40 mol L-1,c(CO32-)= 0.10 molL-1,当BaMoO4开始沉淀时,CO32-的去除率是_____% [已知:Ksp(BaCO3)=1×10-9,Ksp(BaMoO4)=4.0×l0-8]。
(4)“分析纯”的钼酸钠常用钼酸铵[(NH4)2MoO4]和氢氧化钠反应来制取,若将该反应产生的气体与流程中所产生的气体一起通入水中,得到正盐的化学式为_____。
(5)钼酸钠和月桂酰肌氨酸的混合液常作为碳素钢的缓蚀剂。常温下,碳素钢在三种不同介质中的腐蚀速率实验结果如图所示:

①要使碳素钢的缓蚀效果最优,钼酸钠和月桂酰肌氨酸的浓度比应为_____
②碳钢在盐酸和硫酸中腐蚀速率随酸的浓度变化有明显差异,其原因可能是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图所示装置测定中和热的实验步骤如下:
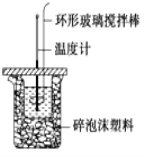
①用量筒量取50mL 0.50molL-1盐酸倒入小烧杯中,测出盐酸的温度,然后把温度计上的 酸用水冲洗干净;
②用另一量筒量取50mL 0.55molL-1 NaOH溶液,并用同一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液最高温度。回答下列问题:
(1)实验中NaOH溶液稍稍过量的目的是_________________________________________。
(2)使盐酸与NaOH溶液混合均匀的正确操作是_______(填序号).
A.用温度计小心搅拌 B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯 D.用套在温度计上的环形玻璃搅拌棒轻轻地上下搅动
(3)实验中改用60mL 0.50mol·L-1盐酸与50mL 0.55mol·L-1 NaOH溶液进行反应,与上述实验相比,放出的热量______________(填“ 偏多”“偏少”或“相等”,下同),所求得的中和热ΔH ______________。
(4)如果上述实验测得中和热ΔH = -55.6kJ/mol,并已知:Ba2+(aq)+2OH-(aq)+ 2H++SO42- (aq)=BaSO4(s) +2H2O(l) ,ΔH=-1584.2 kJ·mol-1。则生成BaSO4(s)的反应热ΔH=______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室以电石(主要成分是CaC2)为原理制备乙炔,装置如图所示。完成下列填空:
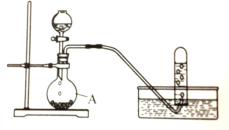
(1)仪器A的名称是______________。
(2)实验室制取乙炔的化学方程式为:___________________________________ 。
(3)为避免电石和水反应过于激烈,除用饱和食盐水代替水外,还需采取的措施是:__________。
(4)为除去乙炔中混有的少量硫化氢杂质,可将气体通过____________(选填编号)。
a.酸性KMnO4溶液 b.CCl4 c.NaOH溶液
(5)乙炔属于_______________(填“饱和烃”或“不饱和烃)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com