
【题目】Q、R、X、Y、Z五种元素的原子序数依次递增。已知:①Z的原子序数为29,其余的均为短周期主族元素;②Y原子价电子(外围电子)排布msnmpn;③R原子核外L层电子数为奇数;④Q、X原子p轨道的电子数分别为2和4。
请回答下列问题:(填写时用对应元素符号或物质的化学式)
(1)五种元素原子中基态时未成对电子数最多的是 。
(2)基态原子Y的轨道表示式是:![]()
(3)基态原子Z的电子排布式是 。向Z的硫酸盐溶液中加入过量氨水时反应的离子方程式是 ,所得产物中含Z元素在内的离子的结构示意图是:(不考虑空间构型,如有配位键,请标出)
(4)Q、R、X的电负性由小到大的顺序是 。
(5)Q、X和Y的氢化物稳定性由小到大的顺序为 。
(6)在一定条件下,原子的核外电子从激发态跃迁到基态产生的光谱属于 光谱(填“吸收”或“发射”),该光谱可用于 。
【答案】(1) N
(2)
(3)![]() ,
,![]() ,
,
(4) C<N<O
(5) SiH4< CH4<H2O
(6)发射, 鉴定元素
【解析】试题分析: Q、R、X、Y、Z五种元素的原子序数依次递增.Z的原子序数为29,则Z为Cu元素.其余的均为短周期主族元素,Q、X 原子p轨道的电子数分别为2和4,Q、X处于第二周期,Q原子核外电子排布为1s22s22p2,故Q为碳元素,X原子核外电子排布为1s22s22p4,则X为氧元素;Y原子价电子(外围电子)排布msnmpn,则n=2,Y处于ⅣA族,则Y为Si元素;R原子核外L层电子数为奇数,L层未排满,则R元素处于第二周期,原子序数介于Q、X之间,则R为氮元素。
(1)五种元素原子中基态时未成对电子数最多的是N,未成对电子数3。
(2)基态原子Si的轨道表示式是:

(3)基态原子Cu的电子排布式是![]() 。向硫酸铜溶液中加入过量氨水时反应的离子方程式是
。向硫酸铜溶液中加入过量氨水时反应的离子方程式是![]() ,所得产物中含Z元素在内的离子的结构示意图是:
,所得产物中含Z元素在内的离子的结构示意图是:
(4)同周期元素电负性逐渐增大,C、N、O的电负性由小到大的顺序是C<N<O。
(5)非金属性越强,氢化物越稳定,CH4、H2O和SiH4的氢化物稳定性由小到大的顺序为SiH4< CH4<H2O。
(6)在一定条件下,原子的核外电子从激发态跃迁到基态产生的光谱属于发射光谱,该光谱可用于鉴定元素。


科目:高中化学 来源: 题型:
【题目】有机化合物甲: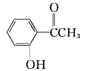 ,乙:
,乙:![]() ,丙:
,丙:![]()
(1)请写出丙中含氧官能团的名称: 。
(2)请判断上述哪些化合物互为同分异构体: 。
(3)请分别写出鉴别甲、乙、丙化合物的方法:(指明所选试剂及主要现象即可)
鉴别甲的方法: ;
鉴别乙的方法: ;
鉴别丙的方法: 。
(4)请按酸性由强到弱排列甲、乙、丙的顺序: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次增加。m、p、r是由这些元素组成的二元化合物,n是元素Z的单质,通常为黄绿色气体,q的水溶液具有漂白性,0.01 mol·L–1r溶液的pH为2,s通常是难溶于水的混合物。上述物质的转化关系如图所示。下列说法正确的是( )

A. 原子半径的大小W<X<Y
B. 元素的非金属性Z>X>Y
C. Y的氢化物常温常压下为液态
D. X的最高价氧化物的水化物为强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有纯铁片、纯银片、纯铜片,稀硫酸、FeSO4 溶液、Fe2(SO4)3溶液、大烧杯、导线若干,请运用原电池原理设计实验,验证Cu2+、Fe3+的氧化性强弱。
(1)写出电极反应式,负极:________________________。正极:________________________。
(2)请在下面方框中画出原电池的装置图,标出外电路电子流向(注明电极材料、电解质溶液,连成闭合回路)。

(3)Cu2+、Fe3+的氧化性由强到弱的顺序为:___________。
(4)该装置反应一段时间后,当溶液的质量增加3.2 g时,通过导线的电子的物质的量是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外兴趣小组对H2O2的分解速率做了如下实验探究。
(1)下表是该小组研究影响过氧化氢 (H2O2)分解速率的因素时采集的一组数据:
用10mL H2O2制取150mLO2所需的时间(秒)
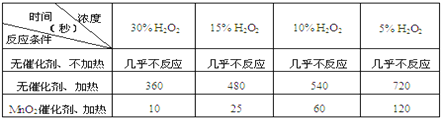
①该研究小组在设计方案时。考虑了浓度、 、 等因素对过氧化氢分解速率的影响
②从上述影响过氧化氢分解速率的因素中任选一个,说明该因素对分解速率有何影响? 。
(2)将质量相同但聚集状态不同的MnO2分别加入到5mL 5%的双氧水中,并用带火星的木条测试。测定结果如下:

①写出H2O2发生反应的化学反应方程式 。
②.实验结果说明催化剂作用的大小与 有关。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】解草酯是一种除草安全剂,可以通过以下方法合成:

(1)化合物D中的含氧官能团的名称为 和 。
(2)化合物B的结构简式为 ;由C→D的反应类型是 。
(3)写出同时满足下列条件的C的一种同分异构体的结构简式 。
Ⅰ.能发生银镜反应Ⅱ.分子含有1个苯环,苯环上含有硝基 Ⅲ.分子中含有4种不同化学环境的氢
(4)已知:![]()
请写出以苯酚和丙醛为原料制备高分子化合物X(结构简式见图)的合成路线流程(无机试剂可任选)。合成路线流程图示例如下:

![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人类对于晶体结构的持续探究揭开了晶体内部的奥秘,并合成了许许多多的新物质、新材料。回答下列问题:
(1)铁有δ、γ、α三种同素异形体,γ晶体晶胞中所含有的铁原子数为 ,δ、α两种晶胞中铁原子的配位数之比为 。
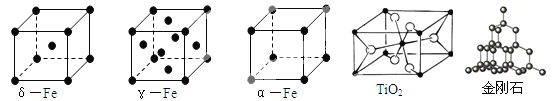
(2)TiO2的天然晶体中,最稳定的一种晶体结构如上图,白球表示: 原子。
(3)NaCl、CO2、SiO2三种晶体熔点由低到高的顺序是 。
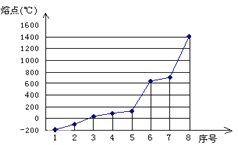
(4)第三周期八种元素按单质熔点由低到高的顺序排列如图所示,其中序号1和8分别代表的是 和 。
(5)已知:Cr3+可形成配位数为6的配合物。组成为CrCl3·6H2O的配合物有3种,分别呈紫色、蓝绿色、绿色,为确定这3种配合物的成键情况,分别取等质量的紫色、蓝绿色、绿色3种物质的样品配成溶液,分别向其中滴入过量的AgNO3溶液,均产生白色沉淀且质量比为3∶2∶1。则绿色配合物的化学式为 (选填代号)。
A.[CrCl(H2O)5]Cl2·H2O B.[CrCl2(H2O)4]Cl·2H2O
C.[Cr(H2O)6]Cl3 D.[CrCl3(H2O)3]·3H2O
(6)根据下表所示键能,写出金刚石(结构如上图)完全燃烧时的热化学方程式 。
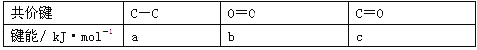
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列几组物质,请将序号填入下列空格内:
A.CH2=CH-COOH和油酸(C17H33COOH)
B.12C60和石墨
C.乙醇和乙二醇
D.
E、35Cl和37Cl
①互为同分异构体的是 ;
②互为同系物的是 ;
③不是同系物,不是同分异构体,也不是同素异形体,但可看成是同一类物质的是
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯甲酸钠(![]() ,缩写为NaA)可用作饮料的防腐剂。研究表明苯甲酸(HA)的抑菌能力显著高于A–。已知25 ℃时,HA的Ka=6.25×10–5,H2CO3的Ka1=4.17×10–7,Ka2=4.90×10–11。在生产碳酸饮料的过程中,除了添加NaA外,还需加压充入CO2气体。下列说法正确的是(温度为25℃,不考虑饮料中其他成分)
,缩写为NaA)可用作饮料的防腐剂。研究表明苯甲酸(HA)的抑菌能力显著高于A–。已知25 ℃时,HA的Ka=6.25×10–5,H2CO3的Ka1=4.17×10–7,Ka2=4.90×10–11。在生产碳酸饮料的过程中,除了添加NaA外,还需加压充入CO2气体。下列说法正确的是(温度为25℃,不考虑饮料中其他成分)
A.相比于未充CO2的饮料,碳酸饮料的抑菌能力较低
B.提高CO2充气压力,饮料中c(A–)不变
C.当pH为5.0时,饮料中![]() =0.16
=0.16
D.碳酸饮料中各种粒子的浓度关系为:c(H+)=c(![]() )+c(
)+c(![]() )+c(OH–)–c(HA)
)+c(OH–)–c(HA)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com