
下列关于实验室制备乙酸乙酯和乙酸丁酯的描述正确的是
A.均采用水浴加热  B.制备乙酸丁酯时正丁醇过量
B.制备乙酸丁酯时正丁醇过量
C.均采用边反应边蒸馏的方法 D.制备乙酸乙酯时乙醇过量
科目:高中化学 来源:2016-2017学年广西桂林十八中高一上期中化学试卷(解析版) 题型:选择题
在除杂过程中要 尽量除去杂质,加入的试剂必须稍过量,且最后过量物质可以使用物理方法或化学方法除去。现要除去NaCl中少量的CaCl2、Na2SO4杂质,下列选用试剂及使用顺序正确的是
尽量除去杂质,加入的试剂必须稍过量,且最后过量物质可以使用物理方法或化学方法除去。现要除去NaCl中少量的CaCl2、Na2SO4杂质,下列选用试剂及使用顺序正确的是
A、Na2CO3、BaCl2、HCl B、BaCl2、Na2CO3、HCl
C、BaCl2、Na2CO3、H2SO4 D、Ba(NO3)2、Na2CO3、HCl
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广西桂林十八中高二上期中文化学卷(解析版) 题型:选择题
当光束分别通过下列分散系时,能观察到丁达尔效应的是( )
A.NaOH溶液 B.Fe(OH)3胶体
C.C2H5OH溶液 D.CuSO4溶液
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广西桂林十八中高二上期中理化学卷(解析版) 题型:实验题
实验室制备1,2-二溴乙烷的反应原理如下:
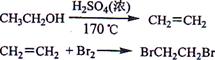
可能存在的主要副反应有:乙醇在浓硫酸的存在下在l 40℃脱水生成乙醚。
用少量的溴和足量的乙醇制备1,2—二溴乙烷的装置如下图所示:
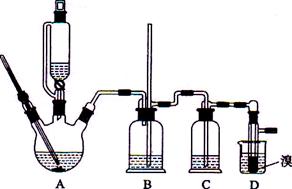
有关数据列表如下:
乙醇 | 1,2-二溴乙烷 | 乙醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/g·cm-3 | 0.79 | 2.2 | 0. |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | 一l30 | 9 | -1l6 |
回答下列问题:
(1)在此制各实验中,要尽可能迅速地把反应温度提高170℃左右,其最主要目的是 ;(填正确选项前的字母)
a.引发反应 b.加快反应速度 c.防止乙醇挥发 d.减少副产物乙醚生成
(2)在装置C中应加入 ,其目的是吸收反应中可能生成的酸性气体:(填正确选项前的字母)
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(3)判断该制备反应已经结束的最简单方法是 ;
(4)将1,2-二溴乙烷粗 产品置于分液漏斗中加水,振荡后静置,产物
产品置于分液漏斗中加水,振荡后静置,产物 应在 层(填“上”、“下”);
应在 层(填“上”、“下”);
(5)若产物中有少量未反应的Br2,最好用 洗涤除去;(填正确选项前的字母)
a.水 b.氢氧化钠溶液 c.碘化钠溶液 d.乙醇
(6)若产物中有少量副产物乙醚.可用 的方法除去;
(7)反应过程中应用冷水冷却装置 D,其
D,其 主要目的是 。
主要目的是 。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广西桂林十八中高二上期中理化学卷(解析版) 题型:选择题
巴豆酸的结构简式为CH3—CH=CH—COOH,现有①氯化氢 ②溴水 ③纯碱溶液 ④2—丙醇 ⑤酸化的高锰酸钾溶液。试根据其结构特点判断在一定条件下能与巴豆酸反的物质组合是( )
A.只有②④⑤ B.只有①③④ C.只有①②③④  D.①②③④⑤
D.①②③④⑤
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广西桂林十八中高二上期中理化学卷(解析版) 题型:选择题
用括号内试剂及操作方法除去下列各物质中的少量杂质,不正确的是
A. 苯中的甲苯(溴水、分液) B. 溴乙烷中的乙醇(水、分液)
C. 乙醇中的水(CaO、蒸馏) D. 溴苯中的溴(NaOH溶液、分液)
查看答案和解析>>
科目:高中化学 来源:2017届宁夏高三上学期统练二化学试卷(解析版) 题型:填空题
在10L恒容密闭容器中充入X(g)和Y(g),发生反应X(g)+Y(g) M(g)+N(g),所得实验数据如下表:
M(g)+N(g),所得实验数据如下表:
实验 编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | |
n(X) | n(Y) | n(M) | ||
① | 700 | 0.40 | 0.10 | 0.090 |
② | 800 | 0.10 | 0.40 | 0.080 |
③ | 800 | 0.20 | 0.30 | a |
④ | 900 | 0.10 | 0.15 | b |
(1) 实验①中,若5min时测得n(M)=0.050mol,则0至5min时间内,用N表示的平均反应速率等于____________。
(2) 实验②中,该反应的平衡常数K=____________。
(3) 实验③中,达到平衡时,X的转化率为____________。
(4) 实验④中,达到平衡时,b____________0.060 (填大于、小于、等于)
(5) 实验③中,达到平衡时,a等于 ____________。
查看答案和解析>>
科目:高中化学 来源:2017届宁夏高三上学期统练二化学试卷(解析版) 题型:选择题
下列说法正确的是( )
A. 强电解质溶液一定比弱电解质溶液的导电性强
B. 强电解质的稀溶液中不存在溶质分子
C. 强电解质都是离子化合物,而弱电解质都是共价化合物
D.不同的弱电解质只要物质的量的浓度相同,电离程度也相同
查看答案和解析>>
科目:高中化学 来源:2016-2017学年云南省高二上期中化学试卷(解析版) 题型:填空题
硫酸工业中SO2转化为SO3是重要的反应之一,在一定压强和催化剂作用下在2L密闭容器中充入0.8molSO2和2molO2发生反应:2SO2(g)+O2(g)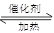 2SO3(g),SO2的转化率随温度的变化如下表所示:
2SO3(g),SO2的转化率随温度的变化如下表所示:
温度℃ | 450 | 475 | 500 | 525 | 550 | 575 | 600 | 650 |
SO2的转化率% | 97.5 | 95.8 | 95.8 | 93.5 | 90.50 | 85.6 | 80.0 | 73.7 |
(1)能判断该反应是否达到平衡状态的是
A.容器的压强不变
B.混合气体的密度不变
C.混合气体中SO3的浓度不变
D.C(SO2)=C(SO3)
E.v正(SO2)=v正(SO3)
F.v正(SO3)=2v逆(O2)
(2)某温度下经2min反应达到平衡后C(SO2)=0.08mol·L-1,
①此时的温度为 ℃
②若将平衡反应混合物的压强增大1倍(假如体积可变),此时Qc为 (可用分数表示),平衡将 向移动。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com